今天的论文,仅应用两个AD模型小鼠的旷场实验+一点点染色实验,就发表了一篇Cell子刊!这篇论文使用的是2D旷场,研究了AD小鼠出现了精细行为异常,比如梳理、抬头行走、快速行走、缓慢行走等行为异常!而这些指标,这些图表,一湾公司的3D-AI动物行为分析系统都能分析!而且是3D的!更加精细!欢迎对AD及神经系统感兴趣的老师广泛关注!基本就是只要有动物模型就能做实验~只要有完整的文章设计就能发文章~
行为变化是神经系统疾病的主要表现形式,但行为的复杂性使准确定义和测量行为充满挑战。目前对疾病引起的行为变化理解仍不全面,主要依赖于特定的迷宫范式,如水迷宫、T 迷宫、Y 迷宫等。近年来,计算机视觉和机器学习技术的发展(如姿势估计和行为分割),为行为量化分析带来了新机遇。这些技术可将小鼠自发行为分解为姿态单元,揭示其序列和层次结构,拓展了行为量化分析的深度。
阿尔茨海默病(AD)在临床痴呆前数十年就开始发展,早期表现为淀粉样蛋白积累等变化。在早期阶段,患者可能出现行为变化,研究这一阶段的行为变化对于理解 AD 的早期病理机制及开发治疗药物具有重要意义。App 基因敲入(KI)和 转基因小鼠模型可以在一定程度上模拟 AD 的病理过程,但受限于技术挑战,尤其是非任务导向范式的行为评估困难。目前很少有研究报道关于 AD 模型小鼠的自发行为变化。最新的一篇论文,系统地研究了 AD 模型小鼠的自发行为差异。
2024年11月26日,美国格拉德斯通研究所Jorge J. Palop研究团队,在Cell Reports发表了题为“Machine learning reveals prominent spontaneous behavioral changes and treatment efficacy in humanized and transgenic Alzheimer’s disease models”的研究论文。该研究通过**借助先进的机器学习算法和视频分析工具,观察模拟AD病理模型小鼠的自发行为,精准捕捉到AD小鼠的自发行为差异,**为探索 AD 动物模型的建立和评估药物治疗效果提供了全新的视角。
老年 App KI 小鼠有轻度空间记忆缺陷和严重的淀粉样病变和神经胶质增生
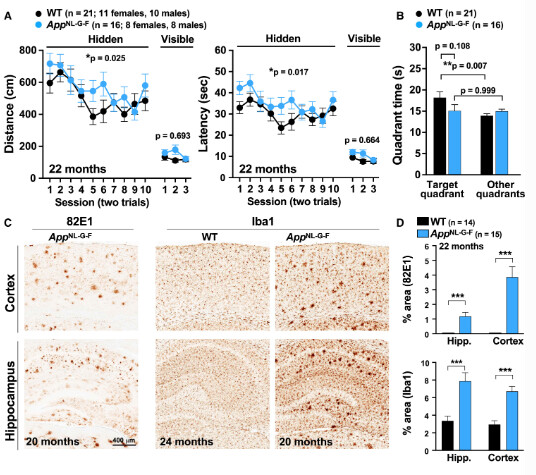
Morris水迷宫实验结果表明,App KI小鼠在隐藏平台(空间定位)任务中的运动距离和潜伏期,与野生型(WT)对照组相比有显著差异。在probe trial(移除平台后)中,这些小鼠对目标象限无明显偏好,提示存在认知受损(图1A, B)。22个月龄的App KI小鼠表现出典型的阿尔茨海默病相关病理特征,包括淀粉样蛋白沉积和神经炎症(图1C, D)。与转基因AD小鼠不同,App KI小鼠似乎仅出现较轻的认知改变。结合文献报道,App KI小鼠可能模拟了AD的前临床阶段,其特点是渐进性淀粉样病变和胶质增生,而未伴随显著的认知衰退、Tau病理或神经退化。
机器学习平台(VAME)可以将小鼠行为序列解构为姿势基序
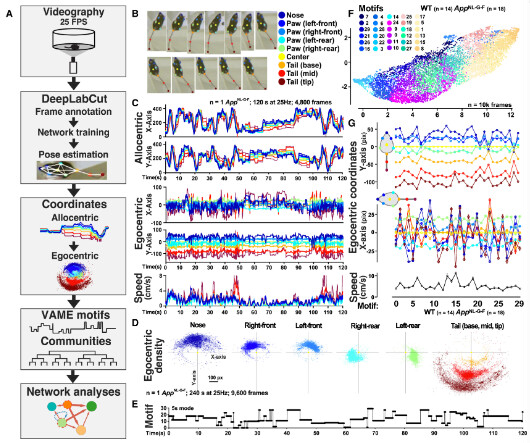
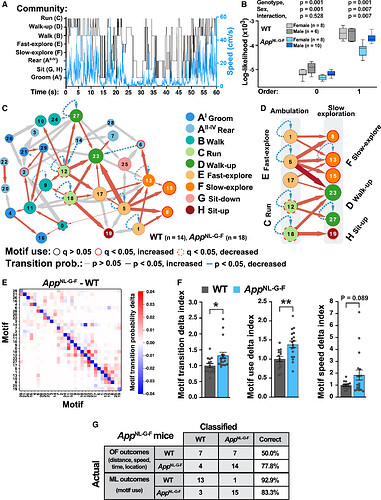
本研究在旷场实验中对13个月龄的App KI小鼠及WT小鼠进行了25分钟的自发行为观察(图2A)。实验通过25帧每秒的俯视视频捕捉小鼠的动作。利用DeepLabCut技术,对小鼠的九个关键部位——包括鼻子、四个爪子、躯干中心以及尾巴的基部、中部和尖端——进行了姿态定位(图2B)。研究生成了小鼠相对于旷场(allocentric)和相对于小鼠自身中心(egocentric)的x-y坐标及其运动速度数据,全面解析了小鼠的行为特征(图2C)。
在小鼠自身中心参考系下,x-y坐标记录了小鼠左右肢等九个身体部位相对于自身中心位置的变化(图2D)。七个关键部位(鼻子、四个爪子、躯干中心和尾巴基部)的自我中心坐标被输入到基于机器学习的变分动物运动嵌入(machine learning-based variational animal motion embedding,VAME)平台中,用于训练一个无监督动态模型。该模型识别出30种不同的姿势基序(motifs)。应用k-means聚类算法为每只小鼠生成唯一的基序序列,发现其以93.8%的准确性正确分类 App KI小鼠及WT(图2E)。为了评估跨性别和基因型的基序特异性,研究使用了UMAP降维和运动学分析,发现每个基序都有一个明确界定的UMAP位置,基序之间过渡平滑(图2F),表明基序特征的特异性和跨基序的行为姿势的连续性。VAME平台能够在无监督的情况下,识别时间序列中的姿势模式,实现可靠且无偏见的行为分割。
雄性和雌性 App KI 小鼠的自发行为表现出明显的年龄依赖性变化
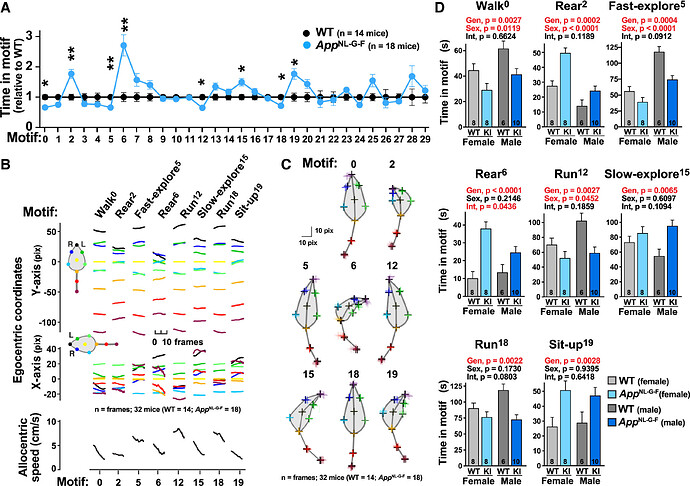
本研究进一步探究了VAME是否能检测年轻(6月龄)及中年(13月龄)App KI小鼠与同龄对照组在自发行为上的差异。研究发现,在6月龄的 App KI小鼠中没有观察到显著的行为变化,而在13月龄的 App KI小鼠中,其行为基序使用情况出现了显著变化。具体来说,在30种已识别的基序中,有8种在App KI小鼠中的使用频率发生了显著改变(图3A)。进一步的运动学和视频分析显示,这8种受影响的基序分别对应于行走(基序0)、快速探索(基序5)、缓慢探索(基序15)、站立(基序2、6)、奔跑(基序12、18)以及坐起(基序19)等行为类别(图3B, C)。上述结果表明,App KI小鼠的自发行为存在显著的年龄依赖性变化。
为了评估基因型与性别之间的相互作用对行为的影响,本研究比较了不同组别中受影响的8种基序的使用时间。分析结果显示,在App基因型的影响下,与疾病相关的行为改变在雄性和雌性小鼠中表现出高度一致性(图3D)。这些发现进一步证实了VAME在分析自发行为差异中的有效性和可靠性。
App KI 小鼠行为基序和行为群的使用模式发生改变
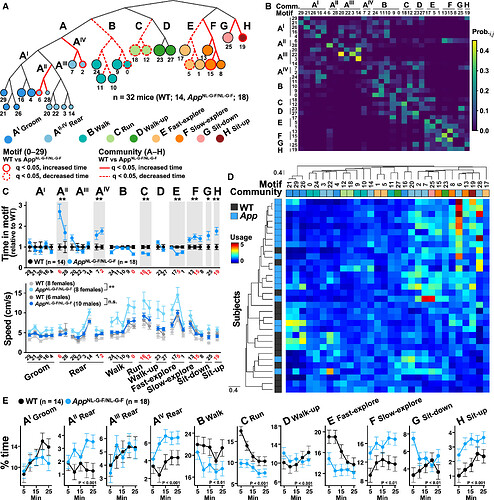
本研究基于行为基序转换的层次聚类分析,明确了30个基序间的层级组织结构,并据此将基序聚类为11个行为群(图4A)。概率矩阵显示,每个群内的基序形成了独立的集群(图4B),这表明小鼠的行为动态具有高度的结构性。在APP影响下,同一行为群中的基序表现出相似的变化趋势(图4C,顶部),验证了行为群的连贯性。这些行为群被标记为梳理、站立、行走、奔跑、抬头行走、快速和缓慢探索、坐下和坐起等。雌性App KI小鼠在行走、奔跑和探索行为上的移动速度显著快于同龄WT对照组(图4C,底部)。
进一步的层次聚类分析显示,App KI小鼠与WT小鼠在基序使用模式上存在显著差异(图4D),表明App KI小鼠整体行为模式异常。研究还发现,基序和行为群的使用受时间和基因型的调节(图4E)。具体表现为,在WT小鼠中,行走、奔跑和快速探索等行为群随着实验时间的延长表现出习惯化特征,即这些行为的出现频率逐渐降低。与此相反,在App KI小鼠中,这些具有习惯化特征的行为群的使用频率从一开始就相对较低。同时,对于那些在WT小鼠中表现出敏感化行为,即随着时间推移使用频率增加的行为群,如站立、缓慢探索和坐起,在App KI小鼠中观察到了更高的使用频率(图4E)。这一发现揭示了App KI小鼠在习惯化和敏感化行为反应上的明显差异,表明这些小鼠的行为模式与WT小鼠存在显著不同。上述结果为理解AD相关的行为变化提供了新的视角。
基序转换的网络分析揭示了 App KI 小鼠的随机性增加和行为序列的改变
本研究通过分解完整的行为-行为转换序列,提供了一种比单一行为模式分析更为敏感的行为检测方法。为了探究完整行为序列的整体结构,本研究评估了25分钟内行为模式转换概率(图5A)。结果显示,App KI小鼠的行为序列可预测性降低,表明其行为组织的随机性增加(图5B)。通过Cytoscape生成的无偏网络可视化揭示了行为模式已组织成行为社区结构(图5C),其中行走(ambulatory)行为作为核心枢纽(图5D)。App KI小鼠表现出不同行为模式转换概率的显著增加,App KI小鼠更倾向于提前从快速探索行为(如快速探索或奔跑)转向慢速探索行为(如行走、坐起或慢探索)(图5D)。最后通过计算行为模式delta指数,以量化小鼠在行为模式转换概率、使用频率和速度上的差异。行为模式delta指数的计算显示,App KI小鼠在行为模式转换和使用上存在显著异常(图5E, F)。总体而言,完整的行为序列分析揭示了App KI小鼠发生了行为序列的改变和随机性增加。
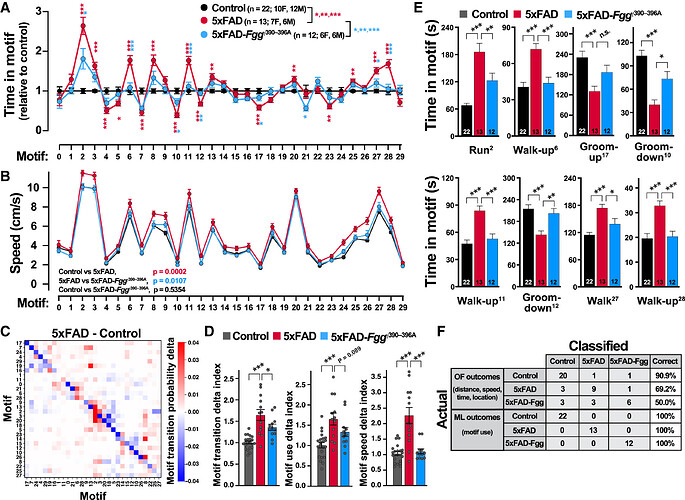
阻断纤维蛋白原-小胶质细胞相互作用可以改善5xFAD 小鼠的自发行为改变
接下来,为识别另一个AD模型中自发行为的变化,并评估这些变化对治疗干预的敏感性,本研究应用了8至10个月龄的5xFAD小鼠,这些小鼠表达野生型纤维蛋白原或一种突变型纤维蛋白原,后者缺乏炎症性CD11b受体结合位点,因此阻止了CD11b受体与小胶质细胞的介导相互作用。凝血因子纤维蛋白原在AD患者的大脑中沉积,是神经毒性小胶质细胞极化和AD小鼠模型中认知障碍的关键介质。研究发现5xFAD小鼠在17个行为模式中表现出显著异常(图6A),而突变型纤维蛋白原表达的小鼠(5xFAD- Fgg 小鼠)几乎完全恢复了这些行为特征,包括行为模式的使用频率和速度(图6B)。进一步计算行为模式的转换、使用频率和速度的delta指数发现,5xFAD小鼠的行为异常在5xFAD-Fgg小鼠中得到显著改善(图6C, D)。5xFAD-Fgg小鼠中显著改善的动作模式被归类为:奔跑(动作模式2)、抬头行走(动作模式6、11和28)、梳理身体上部(动作模式17)、梳理身体下部(动作模式10和12)以及行走(动作模式27)(图6E)。总体而言,自发行为的全面恢复表明,纤维蛋白原在AD相关行为改变中发挥了重要作用,并且这些自发行为改变对治疗干预具有较高的敏感性。
行为转换网络分析揭示了 5xFAD-Fgg 小鼠的治疗性恢复
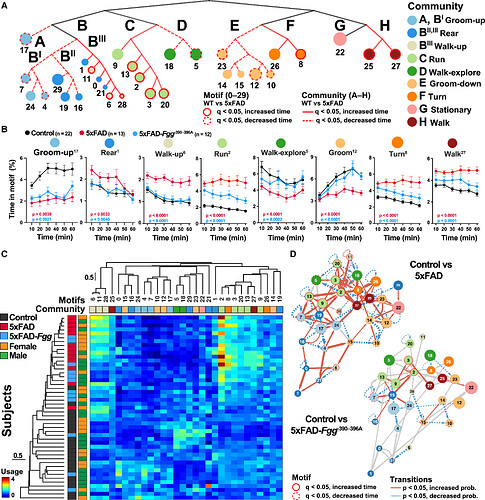
行为树状图分析表明,在9个识别出的行为社区中,8个的行为模式使用情况存在显著差异(图7A,红色分支)。对受疾病影响的代表性行为模式进行时序分析显示,5xFAD- Fgg 小鼠的行为表现接近对照组水平(图7B)。这些结果表明,纤维蛋白原是5xFAD小鼠行为异常的关键调控因子,且VAME检测到的行为改变可作为评估阿尔茨海默病治疗干预的敏感指标。
通过构建行为模式的转换网络(图7D),发现与对照组相比,5xFAD小鼠的行为模式之间存在显著的异常转换概率。具体表现为:5xFAD小鼠在不同行为模式之间的转换频率增加,同时在同一行为模式上停留的概率(自转换)显著降低,表明其行为序列表现出不稳定性。进一步分析发现,在5xFAD- Fgg 小鼠中,大多数由5xFAD引起的转换异常得到了显著缓解。这表明阻断纤维蛋白原-小胶质细胞相互作用不仅恢复了特定行为模式的使用频率和速度,还改善了整体的行为序列结构(图7D)。这一结果进一步支持了纤维蛋白原在调控AD相关行为异常中的关键作用,并为基于此的治疗策略提供了重要依据。
总结
总之,本研究借助VAME平台对App敲入及AD转基因模型小鼠的自发行为进行了评估。研究结果显示,App KI和5xFAD小鼠表现出显著的自发行为变化,具体包括与年龄相关的行为基序使用模式变化、行为序列的改变、行为转换频率的增加以及行为的随机性增强。有趣的是,在5xFAD-Fgg小鼠中,阻断纤维蛋白原与小胶质细胞的相互作用能显著改善自发行为的异常,这表明了神经炎症在行为改变中的关键作用。研究结果表明,AD相关的自发行为改变在基因敲入和AD转基因模型中尤为明显,并且对治疗干预具有敏感性。与传统行为评估方法相比,VAME平台展现出更高的特异性和灵敏度,能够更精确地监测疾病的发展进程及治疗效果。本研究推进了对AD动物模型的自发行为特征的理解,也为药物干预效果的精准评估提供了新的策略。
在探索动物行为分析的先进工具时,不得不提一湾生命科技(BAYONE)的创新产品——BehaviorAtlas 3D-AI动物行为分析系统。本系统不仅能够实现前文提到的复杂分析,而且在行为参数提取和图表可视化上都有出色的表现。如果您希望深入了解其在动物行为研究中的应用,我们非常欢迎您进一步探索!为了帮助您获取更多信息,我们提供了便捷的联系方式。您可以通过公众号私信与我们交流,或者直接扫描下方的微信二维码,我们的专业团队将竭诚为您提供更多信息和帮助。
参考文献:
Miller, Stephanie R et al. “Machine learning reveals prominent spontaneous behavioral changes and treatment efficacy in humanized and transgenic Alzheimer’s disease models.” Cell reports vol. 43,11 (2024): 114870. doi:10.1016/j.celrep.2024.114870