麻醉药会影响社交能力!一湾合作的客户团队最近在《Molecular Psychiatry》上又有新成果啦!他们用“精细行为分析神器”(Social Behavioral Atlas)发现,小鼠早期接触麻醉药,社交能力就“不灵光”了!咱一湾的产品在精细行为分析领域超给力,不仅能研究自闭症、抑郁症,还能搞定麻醉对行为的影响,助力科研一路“超神”!欢迎各位老师阅读文献学习哦!如果对一湾的产品感兴趣也可以咨询我。
麻醉影响社交能力?全身麻醉药物对神经发育的影响,一直是临床与基础研究领域的热门话题。研究发现,生命早期接触麻醉剂,可能会引发社交行为缺陷和树突结构发育异常,不会显著影响学习记忆功能。然而,由于现有诊断工具的灵敏度不足,这些神经发育异常往往被现有评估体系忽视。那么,这些隐藏的风险该如何被精准识别?亟需通过精细化行为表型分析,结合分子机制研究,揭开其背后的病理及行为特征。
2025年3月11日,空军军医大学西京医院麻醉与围手术期医学科董海龙教授/赵广超副教授研究团队在Molecular Psychiatry发表了题为"S-ketamine exposure in early postnatal period induces social deficit mediated by excessive microglial synaptic pruning"的研究论文。该论文通过机器学习辅助行为分析工具Social Behavioral Atlas(SBeA)首次揭示,出生后早期S-氯胺酮暴露通过激活小胶质细胞Stat1-Arg1信号通路引发突触过度修剪与树突结构异常,导致社交缺陷。研究还发现Arg1选择性抑制剂nor-NOHA可以有效逆转此类神经发育障碍。
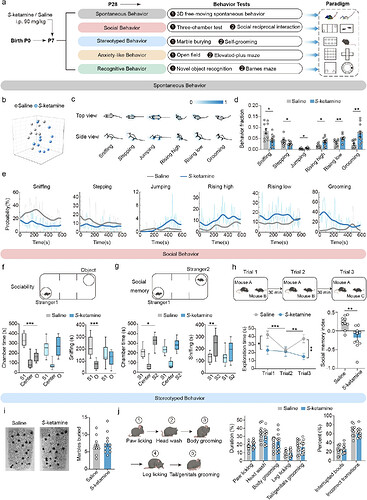
01 出生后早期S-氯胺酮暴露诱导小鼠行为改变
研究团队首先通过剂量梯度实验确定了S-氯胺酮的麻醉效果,发现90mg/kg的给药剂量能够在新生鼠中实现理想的麻醉效果,同时维持其生理参数的稳定。为进一步探究该药物对青春期社交行为的潜在影响,研究者借助先进的3D行为分析框架,对小鼠的自发行为进行了精细化分层解析,成功识别出40种独特的行为亚型。通过对动物行为参数进行降维分析,研究团队发现,S-氯胺酮暴露组与对照组的行为模式呈现出显著差异:暴露组小鼠的探索行为明显减少,而跳跃、站立和自我梳理行为则显著增加。
在经典的三箱社交实验中,S- 氯胺酮 暴露组小鼠的社交能力表现出明显的受损迹象。然而,在埋珠实验和自我梳理行为分析中,两组小鼠的行为表现没有无显著差异。上述结果表明,早期麻醉暴露主要选择性地损害了小鼠的社交认知功能,而并未诱发典型的重复刻板行为。
图1. 图源:Molecular Psychiatry 2025
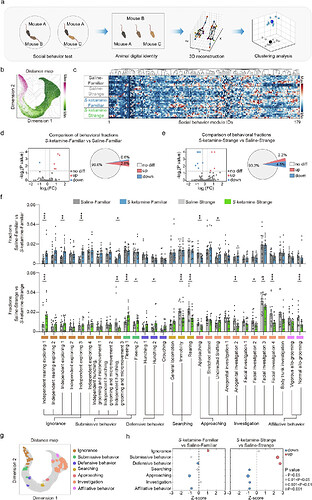
02 S-氯胺酮暴露引起青春期小鼠自发社交能力缺陷
为深入探究S-氯胺酮暴露对青春期小鼠自发社交行为的特异性影响,研究团队采用深度学习驱动的社交行为图谱 (Social Behavioral Atlas, SBeA) 技术,成功捕捉到S-氯胺酮暴露组与对照组小鼠在与陌生或熟悉小鼠同伴互动时的行为差异。
1)在与熟悉小鼠互动时,与对照组相比,S-氯胺酮暴露组小鼠出现了5种行为亚型的明显增多和1种行为亚型的明显减少,将上述行为亚型进行分类后,S-氯胺酮暴露组小鼠对熟悉小鼠的冷漠行为明显增加,接近行为和亲社会行为明显减少。
2)在与陌生小鼠互动时,与对照组相比,S- 氯胺酮暴露组小鼠出现了4种行为亚型的明显增多,即为对陌生小鼠的顺从性和防御性行为明显增加;S-氯胺酮暴露组小鼠出现了8种行为亚型的明显减少,即为寻找行为、接近行为、探索行为和亲社会行为行为明显减少。
上述精细化行为分析表明,S- 氯胺酮暴露显著影响了青春期小鼠与熟悉及陌生小鼠同伴的互动,其自发社交能力出现缺陷。
图2. 图源:Molecular Psychiatry 2025
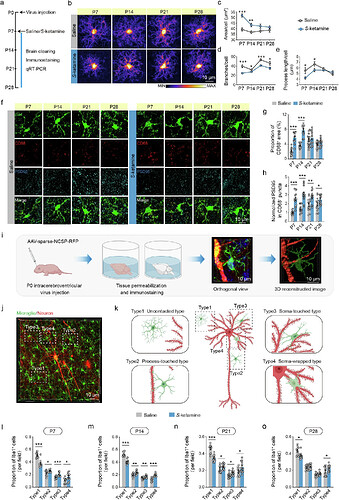
03 S-氯胺酮暴露激活小胶质细胞并增强突触修剪
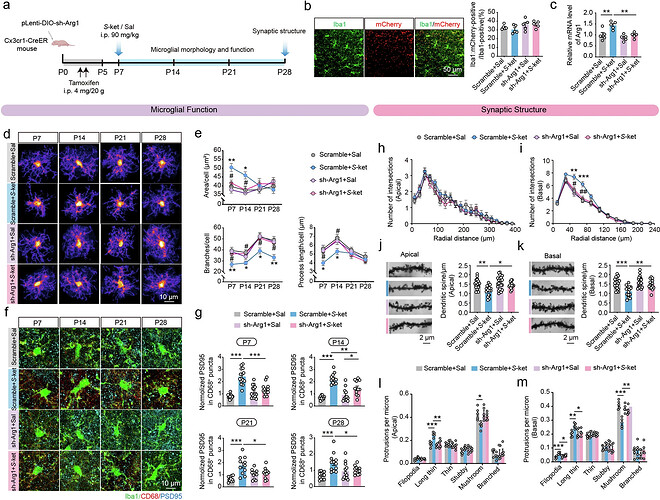
为阐明S-氯胺酮暴露对神经发育的影响机制,研究团队系统追踪了前额叶皮层小胶质细胞的动态变化。发现S-氯胺酮暴露组小胶质细胞从出生后第7天起呈现显著活化表型:胞体面积异常增大伴随分支数量减少及突起长度缩短,这种形态学改变持续至第28天。通过CD68/PSD95共定位分析,发现S-氯胺酮暴露组小胶质细胞吞噬溶酶体活性增强,对兴奋性突触的清除效率从P7至P28持续升高。
研究还发现,S-氯胺酮暴露组小胶质细胞与锥体神经元树突的接触模式发生明显改变。按接触强度分为四类亚型分析显示,P7时暴露组神经元周围未接触型小胶质细胞数量锐减,而突起接触型、胞体接触型及胞体包裹型数量显著增加。这种异常接触模式在P14和P21持续存在,至P28时仍保留未接触型与胞体包裹型的显著差异。这些发现提示,早期麻醉暴露通过重塑小胶质细胞-神经元互作界面,导致 突触 稳态失衡,进而引发神经环路发育异常。
图3. 图源:Molecular Psychiatry 2025
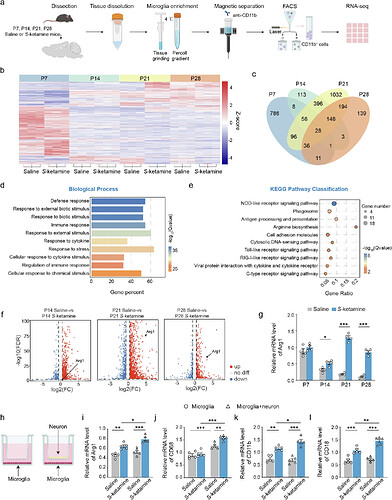
04 S-氯胺酮暴露直接激活了前额叶皮层中小胶质细胞Stat1-Arg1信号通路
为阐明S-氯胺酮暴露对小胶质细胞功能的动态调控机制,研究团队通过跨发育时间点(P7/P14/P21/P28)的RNA测序发现,前额叶皮层 小胶质细胞在四个时间点共存在176个持续差异表达基因(DEGs)。基因本体富集分析显示,这些基因显著富集于外界刺激应答通路,其中精氨酸生物合成通路关键分子(Arg1、Arg2、Nos2、Ass1)及Stat1介导的NOD样受体信号通路异常活跃。qRT-PCR验证显示 Arg1 mRNA 水平在暴露组P14至P28持续升高,与测序数据一致。
通过建立小胶质细胞-神经元体外共培养模型,发现S-氯胺酮处理显著上调小胶质细胞表面标记物CD11b与CD18表达。与单独培养相比,共培养条件下小胶质细胞Arg1、溶酶体标记物CD68 mRNA表达显著升高,提示Arg1的激活依赖于神经元共培养环境,神经元-胶质细胞互作是驱动突触过度吞噬的关键因素。这些发现共同揭示,Stat1-Arg1信号通路是S-氯胺酮诱导小胶质细胞异常激活及突触过度修剪的关键分子通路。
图4. 图源:Molecular Psychiatry 2025
05 小胶质细胞中 Arg1 的上调介导过度突触修剪和异常社会行为
为阐明Arg1信号通路在S-氯胺酮诱导小胶质细胞过度激活中的作用,研究团队构建了Cx3cr1-CreER小鼠模型,通过侧脑室注射靶向敲低Arg1的慢病毒载体,实现前额叶皮层小胶质细胞特异性基因调控。qPCR验证显示,Arg1 mRNA水平在干预组显著下降。形态学分析表明,Arg1敲低可有效逆转S-氯胺酮暴露引发的小胶质细胞异常活化:胞体面积缩小、分支数量增加及突起长度恢复。
CD68/PSD95共定位实验表明,Arg1抑制显著降低小胶质细胞对兴奋性 突触 的过度吞噬,这一效应从P7持续至P28。干预组神经元周围小胶质细胞的突触接触模式趋于正常化。树突结构分析进一步揭示,Arg1敲低不仅能恢复基底树突分支复杂性,还可提升树突棘密度并促进成熟树突棘比例增加。上述结果表明,靶向抑制Arg1信号通路可有效阻断麻醉药物引发的突触稳态失衡与神经发育异常。
图5. 图源:Molecular Psychiatry 2025
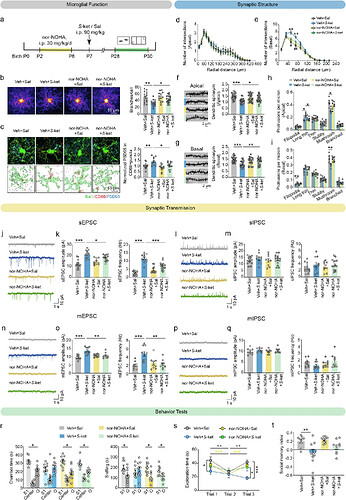
06 Arg1抑制剂Nor-NOHA恢复了小胶质细胞和突触功能,挽救了S-氯胺酮暴露诱导的社会行为缺陷
为进一步研究Arg1信号通路的治疗靶向性,研究团队采用选择性精氨酸 酶抑制剂 nor-NOHA进行药理学干预。新生期小鼠连续5天腹腔注射nor-NOHA(30 mg/kg)后,S-氯胺酮暴露组小鼠前额叶皮层小胶质细胞分支数量显著恢复,CD68+溶酶体内的PSD95免疫反应性增加在P28时降低至对照组水平。nor-NOHA逆转了S-氯胺酮暴露引发的基底 树突 损伤,下调前额叶锥体神经元sEPSC(自发兴奋性突触后电流)和mEPSC(微小兴奋性突触后电流)的异常振幅与频率,对抑制性突触传递(sIPSC和 mIPSC)无显著影响。在三箱社交实验中,与对照组相比,nor-NOHA药物干预组与陌生小鼠互动时间及嗅探时间显著增加,在家笼中与陌生小鼠进行社会互动的探索时间更长,社交记忆指数升高,表明Arg1抑制剂Nor-NOHA改善了S-氯胺酮暴露诱导的社交行为缺陷。
图6. 图源:Molecular Psychiatry 2025
07 BAYONE 助力科研
值得一提的是,该研究论文特别致谢了一湾生命科技(BAYONE)。BAYONE能够在2025年出现在国际学术期刊 Molecular Psychiatry上,源于空军军医大学董海龙/赵广超团队与一湾BehaviorAtlas团队的紧密合作,更离不开团队成员严谨高效的科研素养和对新技术的敏锐洞察。
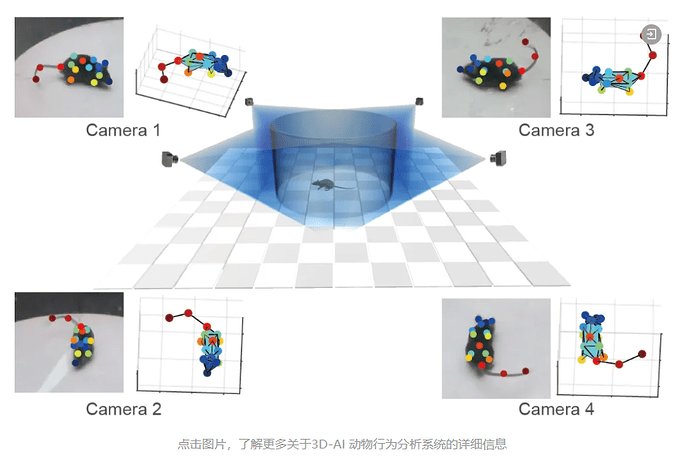
BehaviorAtlas 3D-AI 动物行为分析系统是国内首家3D-AI精细行为学分析系统,可以在三维层面分析动物的精细行为;追踪16+个身体点,实现行为全面量化;提取40+种行为亚型,包括嗅探、梳理、跳跃等行为;计算100+种参数,捕捉动物行为的每一个细节;输出专业级可视化图表,满足SCI论文发表要求。目前,BehaviorAtlas 3D-AI 动物行为分析系统已经在大、小鼠、非人灵长类动物、犬类等模式动物上,针对自闭症、帕金森症、抑郁症、老年痴呆、脑出血等疾病模型以及精神类药物筛选上进行了多种应用。在此,我们也感谢 BehaviorAtlas 的用户对我们系统的关注和支持,希望 BehaviorAtlas 能够帮助更多的科研人员去解答生命科学中的难题。
如果您对 BehaviorAtlas 3D-AI 动物行为分析系统感兴趣,欢迎通过公众号私信或扫描下方的微信二维码联系我们,我们将竭诚为您提供更多信息和帮助。
参考文献:
Zhong H, Xue R, Han Y, Liu L, Zhao J, Cai M, Wang S, Wei P, Zhao G, Dong H. S-ketamine exposure in early postnatal period induces social deficit mediated by excessive microglial synaptic pruning. Molecular Psychiatry. 2025 Mar 11. doi:10.1038/s41380-025-02949-7