3D 步态分析+运动功能分析,正以破竹之势进入动物脊髓损伤研究领域。 它会如何改变动物脊髓损伤研究的格局?让我们一同走进这个充满未知与惊喜的科学世界,本文将分享近年来基于 3D-AI 关节步态分析在脊髓损伤的研究进展。一湾公司推出了【3D-AI动物运动功能分析】的全新系统,欢迎感兴趣的老师咨询!
脊髓损伤(Spinal Cord Injury, SCI)极大地损害患者运动功能,构建精确的动物模型并深入探究其恢复机制的意义重大。传统评估脊髓损伤动物模型的方法, 比如视觉观察和简单运动学测量,存在明显不足。视觉观察主观性强,结果因观察者经验和判断而异,缺乏一致性;简单运动学测量仅能提供步长、步频等基础数据,对关节运动模式的细节信息掌握欠缺。
相比之下,新兴的 3D-AI 关节步态分析技术 为脊髓损伤研究拓展新视野。该技术融合先进的 3D 重建技术,能精准捕捉动物关节的运动轨迹,借助人工智能强大的数据处理与分析能力,可以全面解析 动物的运动行为、关节角度、步态周期 等多 种 参数。通过解读这些参数,能够精准捕捉脊髓损伤动物运动功能的细微变化,为研究脊髓损伤后神经修复机制、评估治疗效果提供客观且全面的数据支撑,有望推动脊髓损伤治疗领域取得突破。
本文将分享近年来基于 3D-AI 关节步态分析在脊髓损伤的研究进展。
01 Nature Neuroscience :3D 步态分析开启脊髓损伤研究新视角
在神经科学领域,3D步态分析技术正引领着动物脊髓损伤研究的前沿方向。一项发表在Nature Neuroscience期刊上的研究论文,借助先进的3D步态分析技术,深入探讨了小鼠脊髓损伤后的运动功能改变,为脊髓损伤研究提供了全新的视角和有力的工具。
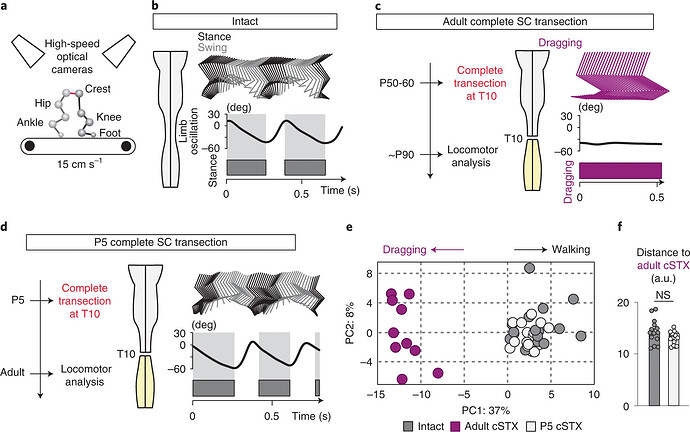
图源:Nature neuroscience 2022 [1]
在小鼠出生后第5天(P5)及成年期第60天(P60)阶段,研究团队分别开展了 T10 水平的脊髓全横断实验操作。经对 102 项参数指标以及步态周期等关键数据进行主成分分析(PCA)后发现:未损伤的小鼠与 P5 时接受脊髓损伤手术的小鼠在后肢运动功能方面呈现出高度相似性,几乎不存在显著的功能差异;而处于成年期 P60 接受脊髓损伤手术的小鼠则表现为后肢完全性瘫痪状态。此论文中应用的是三维有标记追踪,需要在动物多个身体关节点放置物理标记,以实现3D步态分析。这一发现不仅表明了3D步态分析在评估脊髓损伤中的重要作用,也为未来脊髓损伤机制的深入研究和治疗评估提供了坚实的科学依据。
02 Nature Communications:电刺激可恢复脊髓损伤小鼠的运动功能异常
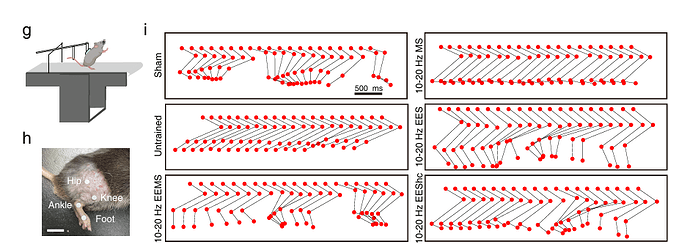
图源:Nature Communications 2024 [2]
电刺激 可以改善脊髓损伤吗?2024年,苏州大学神经科学研究所刘耀波教授团队在Nature Communications上发表的研究,系统地研究了电刺激对脊髓损伤的改善作用及其机制。研究中,团队对小鼠后肢的运动功能进行了分析,并在10-20 Hz刺激频率下,采用脊髓-肌肉双重电刺激系统(EEMS)对脊髓损伤小鼠进行干预。结果表明,未经训练的untrained组小鼠,后肢的踝关节几乎没有弯曲,未能恢复正常步态。10-20 Hz EEMS组后肢踝关节弯曲的程度更大,与假手术组更相似。其他干预组(10-20 Hz EES 和 MS)小鼠的后肢踝关节弯曲表现均差于10-20 Hz EEMS组。以上结果表明10-20 Hz EEMS增强了后肢的运动功能。
03 Communications biology:脊髓损伤恢复中的步态变化与运动功能分析
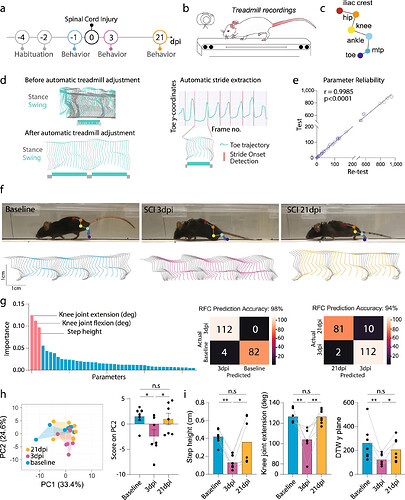
图源:Communications biology 2022 [3]
脊髓损伤不同恢复阶段的后肢运动情况会有不同吗?该研究分析了小鼠在脊髓损伤前以及脊髓损伤后3天和21天的跑步机记录。结果显示,脊髓损伤后3天小鼠的后肢运动轨迹发生显著变化,21天时部分恢复。研究团队基于44个提取的参数应用随机森林分类。在比较基线与损伤后3天的小鼠时,预测受伤状态的准确率为98%;比较损伤后3天和21天的小鼠时,预测恢复状态的准确率为94%。步高、膝关节屈曲和膝关节伸展被确定为基于Gini指数的最重要特征。为深入分析步态变化,研究人员使用主成分分析比较小鼠在脊髓损伤前后的步态。结果表明,损伤后3天的小鼠数据点与基线小鼠明显分开聚集,21天的小鼠则介于两者之间,表明运动功能不完全恢复。PC1和PC2共同解释了58%的总方差,其中PC2更好地反映了组间差异。研究团队识别了最能代表PC2的三个参数,这些参数最有可能代表与SCI相关的差异。步高、膝关节伸展和动态时间规整(DTW)在损伤后3天显示出显著变化,并随着时间逐渐恢复。
上述研究表明,步态分析和运动功能分析在脊髓损伤研究中具有重要意义,它们不仅有助于评估脊髓损伤的程度和恢复情况,还可以用于监测治疗效果。无论是药物治疗、电刺激疗法还是其他康复手段,步态分析+运动功能分析都可以为脊髓损伤等运动功能异常疾病提供客观的评估指标,可以帮助研究人员更好地理解脊髓损伤后的运动功能和步态变化。
04 步态是什么?
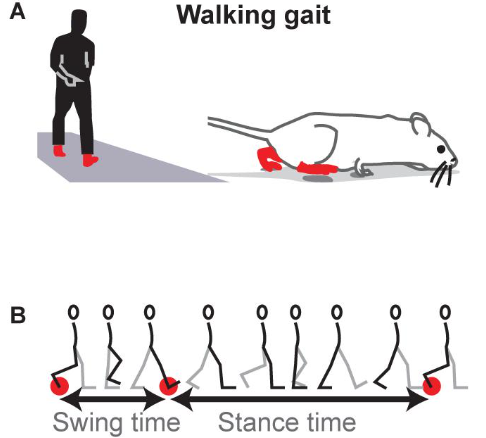
图源:Frontiers in aging neuroscience 2021 [4]
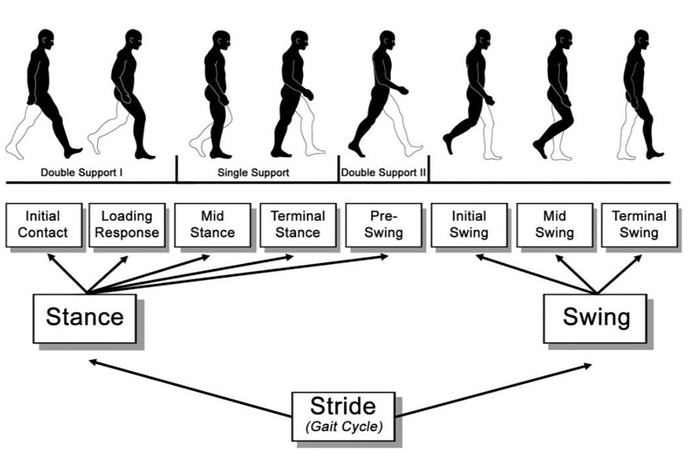
常常听研究人员研究步态,那么步态到底是什么呢?步态(Gait),即行走、站立的运动形式与姿态。一个步态周期大致分为支撑相(Stance phase)和摆动相(Swing phase)两个阶段,支撑相(从脚第一次接触地面开始,到同一只脚离开地面时结束)约占步态周期的60%,是身体重量转移和支撑的关键时期;摆动相(从脚第一次离开地面开始,到同一只脚再次接触地面时结束)约占40%,是肢体向前摆动以实现迈步的阶段 [5]。
图源:www.thebodylab.au/gait-analysis-segments
支撑相5个 + 摆动相3个,像看电影一样看清每个关节怎么动!美国加利福尼亚州 RLA 国家康复中心的 Perry 医生按照步行周期的发生顺序也曾提出了一个分期更为详细的方法——RLA 分期方法,将支撑相 分为 5 个分期,摆动相分为 3 个分期,即初始着地期(Initial contact)、支撑反应期(Loading response)、中点支撑期(Mid stance)、支撑后期(Terminal stance)、摆动前期(Pre-swing)、摆动早期(Initial swing)、摆动中期(Mid-swing)与摆动后期(Terminal swing)。
在脊髓损伤的研究中,通常会将小鼠的步态周期分为支撑相(Stance phase)和摆动相(Swing phase)两个阶段进行分析。一湾生命的BehaviorAtlas 3D-AI小鼠运动功能分析系统也可以实现此类分析哦!
-
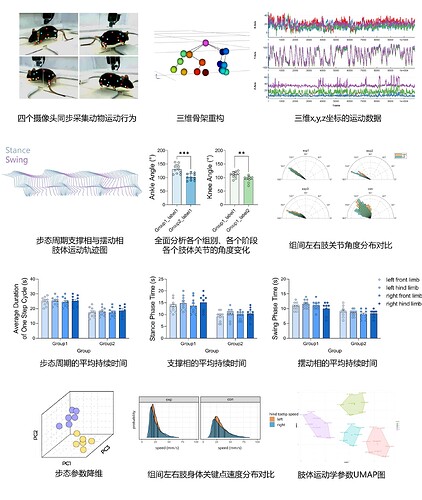
可以计算一个步态周期的平均持续时间、支撑相、摆动相的时间、速度等多种步态指标!
-
可以根据所选步态周期,查看左前肢、右前肢、左后肢、右后肢在该步态周期内的支撑相与摆动相变化情况!
-
可以追踪动物16+个身体点,实现三维层面的运动功能全面量化!
-
可以提供灵活调节的跑步机速度,适合运动损伤小鼠!
-
可以无需任何动物身体标记物,动物实验无干扰!
-
可以适用于脑瘫、脊髓损伤、创伤性脑损伤等运动损伤类疾病!
-
可以输出超50种专业级可视化图表,满足SCI论文发表要求!
05 BehaviorAtlas 3D-AI小鼠运动功能分析系统
传统 3D 追踪方法常应用的三维有标记追踪,需要在动物多个身体关节点放置物理标记,才能实现精准的 3D 步态分析及运动功能分析,而一湾生命科技的BehaviorAtlas 3D-AI小鼠运动功能分析系统,是一款创新的行为分析产品,无需任何动物身体/关节物理标记点,即可精准追踪多个身体(16个以上)关节点的三维坐标。它既能计算步长、步态周期、支撑相、摆动相等多维步态参数,还能精确分析多个身体关节点的运动轨迹、运动速度等多维运动参数,让更精确全面的运动数据触手可及,为神经科学研究提供客观、全面、多维的数据支持。
目前,一湾生命科技的BehaviorAtlas 3D-AI小鼠运动功能分析系统,已服务多位客户研究运动功能异常类疾病,重点在脊髓损伤类疾病研究。在神经科学研究与脊髓损伤治疗的征程中,技术革新是推动我们前行的强劲动力。BehaviorAtlas 3D-AI小鼠运动功能分析系统,突破传统2D步态分析的局限,从3D角度,为研究人员提供了全面且深入的多维运动功能+多维步态分析,可应用于疾病机制研究、药物筛选及疗效评估等方面。如果您也想在科研道路上迈出关键一步,一湾生命的3D-AI小鼠运动功能分析系统将是您的得力助手,与您一同探索神经科学的奥秘,助力每一次重大发现。
如果您对BehaviorAtlas 3D-AI小鼠运动功能分析系统感兴趣,欢迎通过公众号私信或扫描下方的微信二维码联系我们,我们将竭诚为您提供更多信息和帮助。
参考文献:
[1] Bertels, Hannah et al. “Neurotransmitter phenotype switching by spinal excitatory interneurons regulates locomotor recovery after spinal cord injury.” Nature neuroscience vol. 25,5 (2022): 617-629. doi:10.1038/s41593-022-01067-9
[2] Zhou, Kai et al. “Dual electrical stimulation at spinal-muscular interface reconstructs spinal sensorimotor circuits after spinal cord injury.” Nature communications vol. 15,1 619. 19 Jan. 2024, doi:10.1038/s41467-024-44898-9
[3] Aljovic, Almir et al. “A deep learning-based toolbox for Automated Limb Motion Analysis (ALMA) in murine models of neurological disorders.” Communications biology vol. 5,1 131. 15 Feb. 2022, doi:10.1038/s42003-022-03077-6
[4] Broom, Lauren et al. “Shifts in Gait Signatures Mark the End of Lifespan in Mice, With Sex Differences in Timing.” Frontiers in aging neuroscience vol. 13 716993. 2 Aug. 2021, doi:10.3389/fnagi.2021.716993
[5] 蔡伟创.CR-TKA术前、术后步态运动学特征及临床相关性研究[D].中国人民解放军海军军医大学,2023.DOI:10.26998/d.cnki.gjuyu.2023.000132