在神经科学研究中,精准捕捉动物瞳孔变化特征对解析神经机制至关重要。Neuron最新发表的一篇研究论文,应用了一湾生命科技(BAYONE)与中国科学院深圳先进技术研究院脑所联合自主研发的 AI 动物眼动追踪技术,解析瞳孔动态与神经环路调控网络。一湾生命科技 CTO 黄康博士作为重要作者参与研究。瞳孔变化的精准捕捉,为揭示个体行为适应差异的神经机制提供了关键窗口。一湾生命科技小鼠移动眼动追踪系统(AI瞳孔追踪)与小鼠固定眼动追踪系统(1000帧/秒),可在自由移动与头部固定双场景下获取瞳孔参数,为神经机制研究提供高精度动态瞳孔数据采集与分析的技术解决方案,为神经科学研究提供有力支撑。
达尔文在《物种起源》中提出 “个体差异是自然选择和物种进化的基础”,探究行为适应的神经机制便成为理解生物多样性及个体生存策略生物学基础的关键。面对恐惧时,有人会 “一朝被蛇咬,十年怕井绳”,产生持久恐惧反应;也有人能快速习惯化,展现出截然不同的应对模式。本能情绪反应(比如恐惧行为)是大脑中与生俱来的、在进化上保守的机制,能够促使生物体规避威胁,保障生存。这些反应受内部状态严格调节,既影响特定防御行为的发生,又决定适应性策略的选择。觉醒状态是内部状态的核心要素之一,在塑造生物体对环境挑战的适应性反应方面起着关键作用。当生物体单次遭遇捕食者时,通常会触发即时的防御反应;而反复暴露于威胁之下,则可能引发两种应对策略 —— 习惯化或敏感化,这两种策略依赖于感觉输入、内部状态以及过往经验。然而,在内部状态调控方面,以及个体在对反复出现的威胁产生习惯化的差异背后所涉及的神经环路机制,目前仍不明确。
2025年5月9日,中国科学院深圳先进技术研究院王立平、刘雪梅研究团队在Neuron杂志上发表了题为“Neural Circuit Underlying Individual differences in Visual Escape Habituation”的研究论文。本研究首次系统性鉴定了重复视觉威胁下两种典型行为表型 —— 持续性快速逃避(T1)和快速习惯化(T2),揭示其分别依赖上丘 / 岛叶皮层-腹侧被盖区-基底外侧杏仁核和上丘 / 岛叶皮层-丘脑背内侧核-基底外侧杏仁核神经通路。丘脑背内侧核整合感觉信息调控觉醒与恐惧反应,基底外侧杏仁核 β 振荡参与恐惧状态调节,研究不仅阐明了个体在威胁习惯化过程中存在差异的机制,还为神经环路、行为适应与内部状态调节三者间的相互作用提供了全新见解。
01 重复 Looming 刺激下逃避行为习惯化的个体差异
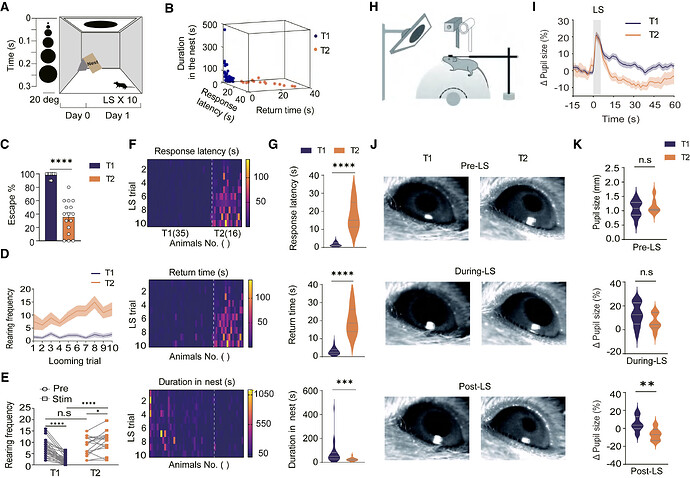
Looming 刺激(LS)能可靠的诱发小鼠先天性逃避行为。本研究通过对 52 只野生型成年雄性小鼠进行重复 LS 刺激(每只每次实验接受 10 次 5.5 秒刺激,间隔≥2 分钟),发现除 1 只未表现反应外,其余个体的逃避行为呈现显著分化:
1. 持续性快速逃避(T1): 35 只小鼠在每次 Looming 刺激中均于 5.5 秒内启动逃跑;
2. 快速习惯化(T2): 16 只小鼠至少有 1 次 Looming 刺激的逃跑潜伏期 ≥ 5.5 秒。
与 T1 组相比,T2 组小鼠平均逃避比例更低,潜伏期与返回巢穴的时间更长,巢穴停留时间更短。T2 组在全刺激周期内的反应频率(RF)显著高于 T1 组,且其 RF 在 LS 刺激后呈升高趋势,而 T1 组表现为降低,且刺激前两组 RF 无显著差异,提示两组具有刺激特异性的反应模式特征。通过瞳孔测量法评估觉醒状态发现,T1 组在 LS 刺激后 10 秒的瞳孔直径显著大于 T2 组,刺激前及刺激期间无组间差异。综上,作为快速习惯化表型的 T2 型小鼠,在重复 LS 刺激下表现出增强的刺激诱发非选择性注意力(NSA)及降低的觉醒反应特征。
图 1. 对重复 Looming 刺激的逃避行为习惯化个体差异。图源:Neuron 2025
02 SC-MD 与 SC-VTA 通路的激活模式驱动特异性钙信号动态变化
为研究上丘(SC)神经元在 Looming 刺激习惯化中的作用,研究采用 FosTRAP2 技术,通过病毒注射标记激活的 SC 神经元。
第 1 天,向 FosTRAP2 小鼠单侧上丘注射携带 AAV5-DIO-EGFP 的腺相关病毒;
第 3 天,对小鼠注射他莫昔芬并暴露于重复 Looming 刺激以激活标记细胞;
第 24 天,在脑组织灌流前再次对小鼠进行 Looming 刺激。
结果表明,T1 组 EGFP+ SC 神经元密度显著高于 T2 组,与 Looming 刺激相关的 EGFP+ SC 神经元在中间层和深层呈现更强激活,而浅层无显著差异,提示上丘在促进逃避行为中发挥作用。进一步通过钙成像发现,T2 组丘脑背内侧核(MD)激活显著强于 T1 组,而 T1 组腹侧被盖区(VTA)激活更强。逆向追踪实验显示,Looming 刺激下 T2 组 SC-MD 投射激活更强,T1 组 SC-VTA 投射激活更显著。上述结果表明,T1 组依赖 SC-VTA 通路促进恐惧学习,T2 组则通过 SC-MD 通路增强感觉处理与觉醒调控。
图 2. 状态依赖性的SC-MD 与 SC-VTA 通路激活驱动不同的钙动态变化。图源:Neuron 2025
03 投射至 VTA 和 MD 的 SC 神经元功能性地靶向 BLA
为探究投射至腹侧被盖区(VTA)和丘脑背内侧核(MD)的上丘(SC)神经元是否在基底外侧杏仁核(BLA)汇聚,研究采用 AAV1 介导的顺行跨突触标记技术,向 SC 注射 AAV1-Cre 病毒,随后分别向 MD 和 VTA 注射 AAV5-DIO-EYFP 和 AAV5-DIO-mCherry 病毒。Cre 表达显示,BLA 中存在轴突投射重叠区域,表明投射至 VTA 和 MD 的 SC 神经元共同支配 BLA 内特定区域。荧光密度分析表明,投射至 VTA 的 SC 神经元主要支配 BLA 内侧区,而投射至 MD 的神经元则靶向 BLA 前部和后部。综上,BLA 作为 SC-MD 和 SC-VTA 通路的下游整合枢纽,负责处理两条通路传递的不同感觉及觉醒相关信号。
图 3. 投射至 VTA 及 MD 的 SC 神经元靶向 BLA。图源:Neuron 2025
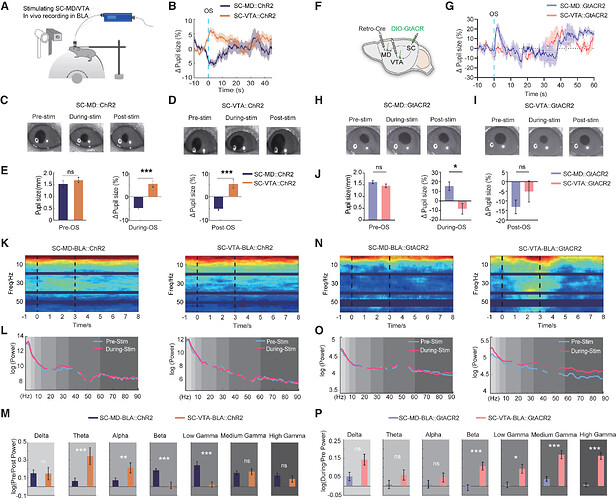
04 SC 通路调节 BLA 振荡及瞳孔相关觉醒状态
为探究 SC-MD 与 SC-VTA 通路对基底外侧杏仁核(BLA)威胁编码及神经动力学的调控机制,研究通过光遗传学技术选择性激活或抑制两条通路,结合瞳孔测量与 BLA 多通道电生理记录分析其功能差异。结果显示,激活 SC-MD 通路诱发瞳孔收缩,而 SC-VTA 激活导致瞳孔扩张,抑制则产生相反效应;基线瞳孔大小无差异,但刺激期间 SC-VTA 组瞳孔显著更大。电生理记录表明,SC-VTA 激活增强 BLA 的 Theta 和 Alpha 振荡功率,SC-MD 激活则提升 Beta 和低 Gamma 功率;抑制 SC-VTA 通路会显著增加 Beta、低 Gamma 及高 Gamma 功率,提示觉醒相关神经振荡的代偿性改变。综上,SC-MD 与 SC-VTA 通路在调控觉醒状态、感觉处理、觉醒相关神经振荡及 BLA 威胁调控机制中具有不同的功能。
图 4. SC-MD 与 SC-VTA 环路激活或抑制对瞳孔大小变化及 BLA 振荡动力学的调控作用。图源:Neuron 2025
05 SC 通路差异调节 Looming 刺激下的逃避反应
为探究 SC-MD 与 SC-VTA 通路对 T1 和 T2 型小鼠重复 Looming 刺激行为反应的调控作用,研究通过化学遗传学抑制方法,向 MD 和 VTA 注射 AAV-retro-Cre 病毒并在 SC 表达抑制性受体 hM4Di,分析氯氮平-N-氧化物(CNO)处理前后的行为变化。结果显示,抑制 SC-VTA 通路广泛影响两组小鼠的逃避及学习相关行为,而抑制 SC-MD 通路仅特异性增加 T2 型小鼠的巢穴停留时间,对 T1 组及 T2 组其他行为参数无显著作用。上述结果表明, SC 亚环路在威胁适应性反应中存在精细的功能分工:
1. SC-VTA 通路对不同表型防御行为具有普遍性调控效应;
2. SC-MD 通路则针对性影响 T2 型小鼠相关行为。
图 5. SC-MD 与 SC-VTA 环路抑制对 T1 和 T2 型小鼠重复 Looming 刺激反应模式的影响。图源:Neuron 2025
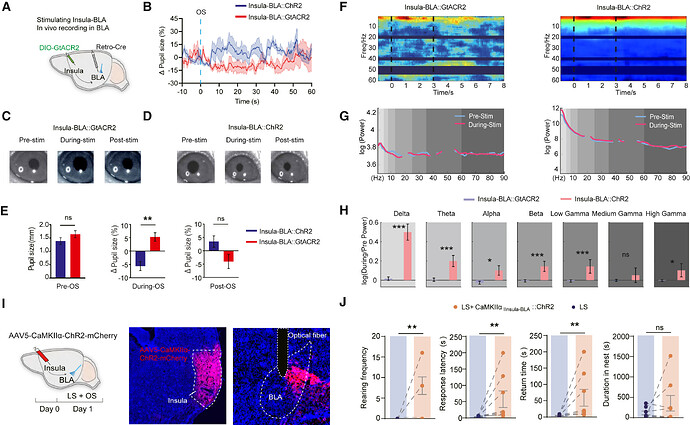
06 不同岛叶皮层环路调控 BLA 振荡及瞳孔相关觉醒
为研究岛叶(insula)相关通路的功能,研究通过向丘脑背内侧核(MD)或腹侧被盖区(VTA)注射 Retro-Cre 病毒,并在岛叶表达抑制性蛋白 GtACR2,实现环路特异性调控。瞳孔测量显示,激活insula-MD通路诱发瞳孔收缩,insula-VTA 通路激活导致瞳孔扩张,抑制则导致相反结果;刺激期间及之后,insula-VTA 组瞳孔显著大于insula-MD组。同步记录基底外侧杏仁核(BLA)电活动发现,insula-MD激活增强 Delta、Theta、Alpha 及 Beta 频段振荡功率,而抑制两条通路对 BLA 局部场电位无显著影响。上述结果表明,岛叶通过不同下游通路调控觉醒与注意力:
1. insula-MD 通路通过降低觉醒水平抑制逃避行为;
2. insula-VTA 通路提升觉醒水平,但不影响逃避行为。
图 6. insula-MD 与 insula-VTA 环路激活或抑制对瞳孔大小及 BLA 振荡动力学的调控作用。图源:Neuron 2025
为探究 insula-MD 与 insula-VTA 通路在逃避习惯化中的特异性作用,本研究检测了两条通路抑制对 T1 和 T2 型小鼠的行为影响。结果显示,抑制insula-MD通路对 T1 组行为无显著作用,但特异性缩短 T2 组小鼠的反应潜伏期,表明该通路在重复威胁暴露下可促进对威胁的更快反应;而抑制insula-VTA 通路对两组小鼠的逃避行为均无显著影响。上述结果表明:
1. insula-MD 通路通过提升重复威胁下的反应效率,参与适应性时间调控与决策过程;
2. insula-VTA 通路在本研究观察的逃避行为中没有明显的功能相关性。
图 7. Insula-MD 与 Insula-VTA 环路抑制对 T1 和 T2 型小鼠 Looming 刺激反应模式的影响。图源:Neuron 2025
07 岛叶皮层直接调控 BLA 振荡及觉醒相关反应
为探究岛叶是否直接调控瞳孔动态、调制基底外侧杏仁核(BLA)活动并影响防御决策过程,本研究结合体内电生理记录、瞳孔测量技术及岛叶-基底外侧杏仁核通路的靶向操控开展实验。结果显示,激活岛叶-BLA 通路可显著诱发瞳孔收缩,而抑制该通路则导致瞳孔扩张。进一步分析表明,与通路抑制状态相比,兴奋岛叶-BLA 通路能有效增强 BLA 在 Delta、Theta、Alpha、Beta 及低 Gamma 频段的振荡功率,揭示其对 BLA 神经网络动态的增强调制作用。上述结果表明,岛叶-基底外侧杏仁核通路可直接调控瞳孔动态及基底外侧杏仁核活动,并对防御决策过程产生选择性影响。
图 8. 岛叶-基底外侧杏仁核通路激活通过增强瞳孔收缩及杏仁核活动消除恐惧。图源:Neuron 2025
08 总结
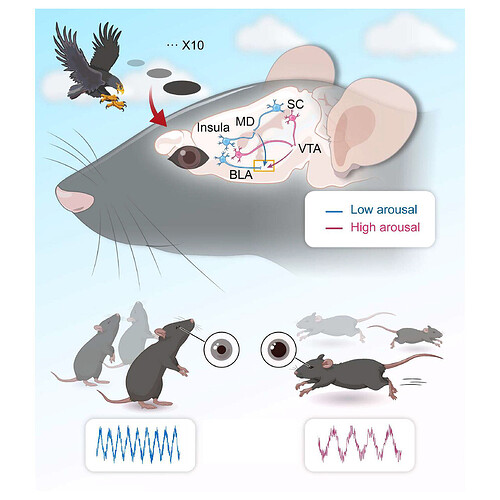
本研究发现,小鼠在重复视觉威胁表现出两种行为反应表型:持续逃避型(T1)与快速习惯化型(T2)。源自上丘与岛叶的不同神经通路分别投射至基底外侧杏仁核,并参与调控不同水平的防御觉醒状态及对重复Looming刺激的习惯化反应。T1 模式依赖上丘(SC)/岛叶皮层(Insula cortex)-腹侧被盖区(VTA)-基底外侧杏仁核 (BLA) 神经通路;T2 模式通过上丘/岛叶皮层-丘脑背内侧核(MD)-基底外侧杏仁核神经环路实现。总之,本研究揭示了本能恐惧反应策略个体差异的神经环路机制,对于解析生物环境适应策略提供理论支撑,也为探索精神疾病病理机制及治疗策略提供新思路,具有重要理论与临床意义。
图形摘要. 本能恐惧反应策略个体差异的神经环路机制。图源:Neuron 2025
BAYONE 助力科研
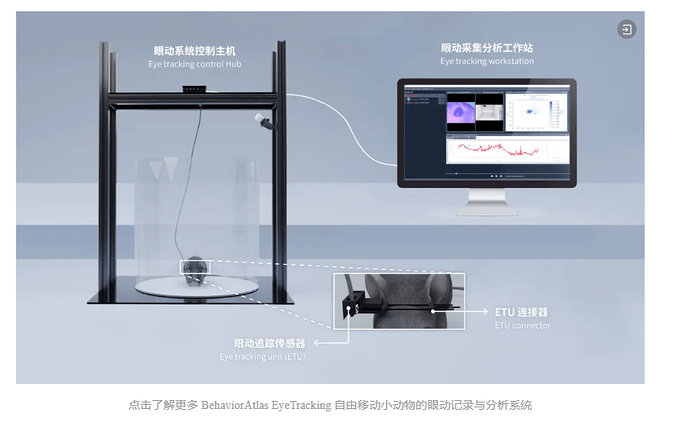
本研究使用了一湾生命科技(BAYONE)研发的动物眼动追踪技术, CTO 黄康博士作为重要作者参与研究,为研究提供了关键技术支撑。一湾生命科技自主研发的动物眼动追踪系统包括两款核心产品:小鼠移动眼动追踪系统和小鼠固定眼动追踪系统,为神经行为学研究提供了创新技术方案。
小鼠移动眼动追踪系统搭载先进的 AI 眼部特征检测算法,可在动物无束缚活动\自由移动状态下实现瞳孔动态记录,支持瞳孔位置、直径、面积及移动速度等多维度指标提取和可视化;小鼠固定眼动追踪系统配备高速采集设备(每秒录制高达1000帧),能够精准捕捉眼动变化,提供曲线图、散点图、热图等多种可视化图表。两套系统均通过技术创新突破了传统动物眼动检测的限制,为神经科学研究中瞳孔动态与神经行为的关联性研究提供了高效可靠的技术平台。
如果您对BehaviorAtlas 动物眼动追踪系统感兴趣,欢迎通过公众号私信或扫描下方的微信二维码联系我们,我们将竭诚为您提供更多信息和帮助。
参考文献:
Liu X, Lai J, Han C, Zhong H, Huang K, Liu Y, Zhu X, Wei P, Tan L, Xu F, Wang L. Neural circuit underlying individual differences in visual escape habituation. Neuron. 2025 May 8:S0896-6273(25)00301-0. doi: 10.1016/j.neuron.2025.04.018.