2025 年 4 月,上海中医药大学附属岳阳中西医结合医院吴焕淦教授、上海市精神卫生中心陈剑华研究员团队在 FASEB J 发表最新研究论文,揭示电针疗法可减少奥氮平副作用。一湾生命科技为该研究提供了 AI 精细动物行为解析的技术支持。
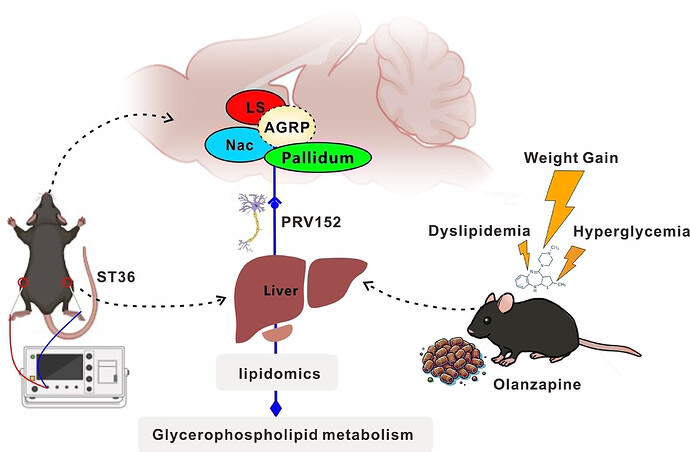
精神疾病患者需长期用抗精神病药(如奥氮平)控制病情,但可能引发代谢异常、肝损伤等问题。此时,电针疗法正崭露头角。它安全又经济,在减重调脂、改善代谢与肝功能方面潜力十足,尤其刺激足三里穴(图中红色位置),已被证实能精准调控肝脏功能和脂质代谢,还能影响中枢与肝脏的双向通讯 —— 这或许正是破解药物副作用的钥匙。
2025 年 4 月,上海中医药大学附属岳阳中西医结合医院吴焕淦教授、上海市精神卫生中心陈剑华研究员团队在 FASEB J 发表了题为“Effect of electroacupuncture at Zusanli reduced Olanzapine-induced lipid disturbances in mice via potential liver-brain interaction”的研究论文。研究评估了电针刺激足三里穴(ST36)对奥氮平诱发的肥胖和血脂异常的疗效,并探讨了肝脑调控机制。一湾生命科技为该研究提供了 AI 精细动物行为解析的技术支持。
01 奥氮平诱导小鼠体重增加及行为功能障碍
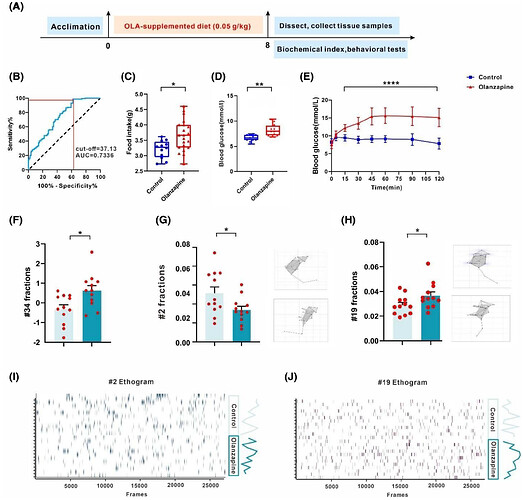
研究采用0.05g/kg奥氮平掺入标准鼠粮饲喂小鼠,持续8周监测体重、摄食量和血糖水平(图1A)。通过五批次共247只小鼠的重复实验证实奥氮平致肥胖表型,并采用受试者工作特征(ROC)曲线确定体重增长临界值:曲线下面积(AUC)为0.7336,敏感度与1-特异度临界值为37.13%(图1B),表明体重增幅超37.13%即为奥氮平诱导肥胖标准。肥胖小鼠中,奥氮平显著增加摄食量并升高空腹血糖(图1C, D);口服葡萄糖耐量试验(OGTT)显示给药组血糖全程显著升高(图1E)。
采用一湾生命科技的三维精细行为分析动物的自发行为发现:奥氮平组小鼠原地嗅探行为显著减少(图1G,I),而小跑和行走嗅探行为显著增加(图1F-J),提示奥氮平诱导小鼠精细行为改变,促进探索性嗅探并增加摄食倾向。
02 电针刺激足三里穴改善奥氮平引起的代谢紊乱
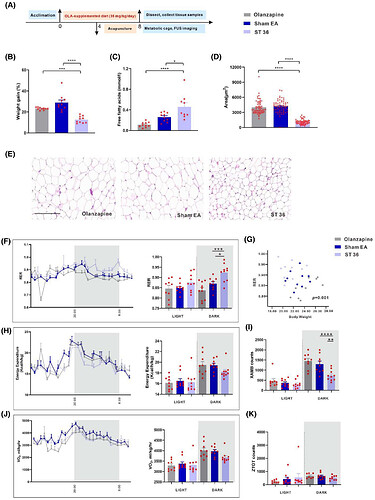
研究评估电针足三里穴(ST36)对奥氮平诱导代谢异常的作用(图2A)。与奥氮平组及假电针组相比,ST36电针组小鼠呈现体重减轻(图2B)、血清游离脂肪酸(FFA)水平升高(图2C)、脂肪细胞面积缩小(图2D, E)。组织学检测(HE染色)证实ST36组脂肪细胞面积显著减小。
代谢笼监测显示:奥氮平组呼吸交换率(RER)下降,而ST36电针组RER值显著恢复(图2F, G),且该恢复与运动活性无关(图2I)。能量消耗、耗氧量(VO₂)及垂直运动活性(ZTOT)未受电针调控(图2H-K)。电针ST36通过逆转奥氮平引起的RER下降及FFA代谢紊乱,有效改善代谢异常。
03 电针刺激足三里穴对奥氮平处理小鼠肝脏脂质组的影响
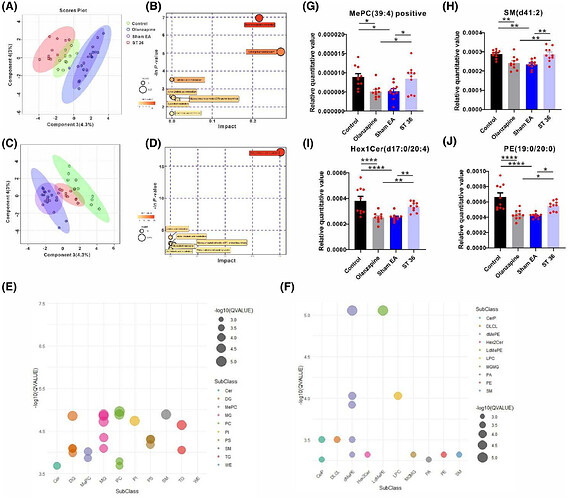
为明确奥氮平处理后的脂质代谢变化及差异脂质生物标志物,采用液相色谱 - 质谱联用技术对各组小鼠肝脏进行非靶向脂质组学研究。稀疏偏最小二乘判别分析显示,假电针组与奥氮平组脂质谱聚类,显著区别于ST36组和对照组(图3A 正检测模式;3C 负检测模式)。KEGG通路分析表明差异脂质主要富集于甘油磷脂代谢、亚油酸代谢及GPI锚定生物合成通路(图3B 正检测模式;3D 负检测模式)。正检测模式中,神经酰胺、甘油二酯、甲基磷脂酰胆碱等脂质亚类差异显著(图3E);负检测模式中,己糖神经酰胺、磷脂酰乙醇胺、鞘磷脂等脂质亚类差异显著(图3F)。关键差异分子包括POC-MePC、NEG-SM、NEG-Hex1Ce、NEG-PE(图3G-J),ST36电针组上述脂质水平均恢复至近对照组状态。
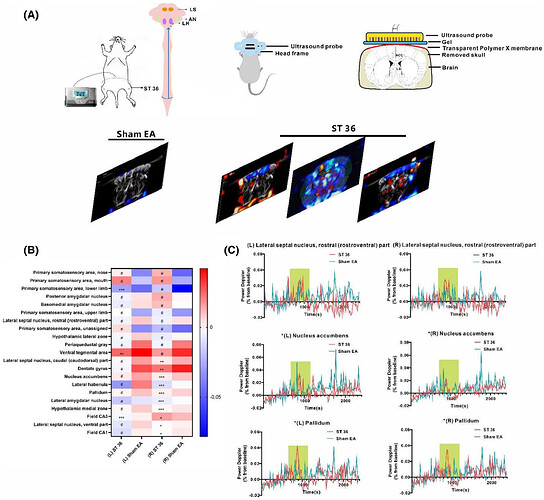
04 通过功能性超声识别电针刺激足三里穴激活的潜在脑区
为探究 ST36 治疗的中枢机制,论文利用功能性超声成像(fUS)评估其疗效,检测了大脑大部分区域的活动:范围从 ST36 3 mm 到 ST36 -3 mm(图4A)。扫描显示,同侧及对侧躯体感觉皮层均呈强激活,而外侧隔核、伏隔核、苍白球及下丘脑较假针刺组显著抑制(图4B, C)。躯体感觉皮层同步激活提示针刺影响躯体感觉神经功能;其余区域或为电针 ST36 调节奥氮平诱导的体重增加及脂肪酸代谢异常的关键神经环路,可能在抵抗该体重增加中起重要作用。
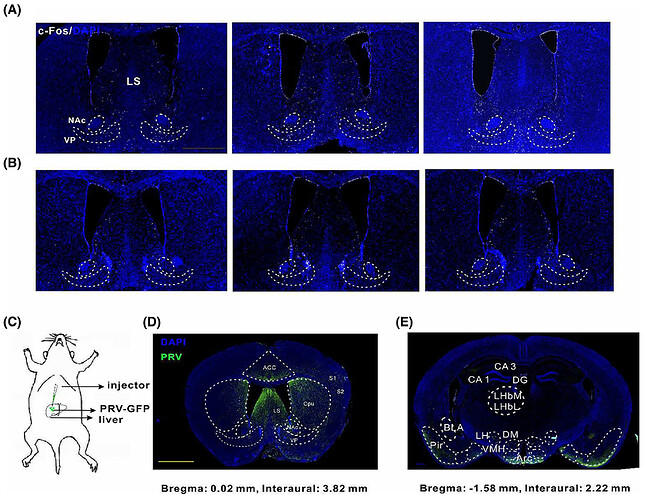
05 电针刺激足三里穴激活脑内肝脏上游调控通路中AGRP阳性神经元
为证实 ST36 穴针刺确实能显著改变上述 fUS 筛选出的针刺反应脑区中神经元的活动,发现针刺组 c-Fos+ 神经元显著减少(图5A, B)。为明确参与这些神经元与肝脏连接的神经元特征,向成年雌鼠肝脏注射编码 EGFP 的 PRV 以逆行跨突触标记上游神经元。注射后 4-5 天,双侧躯体感觉皮层、尾壳核、外侧隔核、伏隔核及苍白球可见 EGFP + 神经元簇(图5C-E),而对照组这些区域无标记神经元。
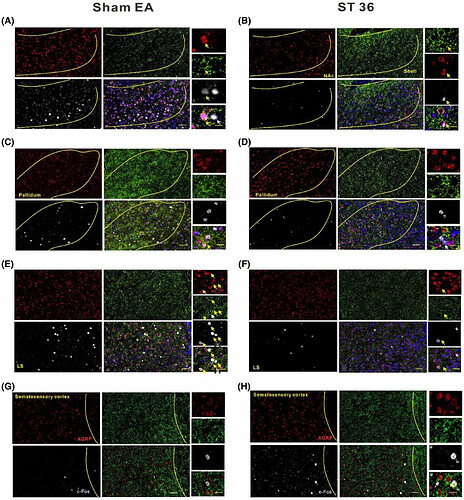
c-Fos 与 AGRP 等共染色显示,外侧隔核、伏隔核及苍白球中 c-Fos+/AGRP + 神经元数量显著减少(图6),躯体感觉皮层中多数表达 c-Fos 的神经元激活增强。结果表明,电针 ST36 时,外侧隔核、伏隔核及苍白球中失活的 AGRP+ 神经元是肝脏的跨 突触 上游神经元。
06 总结
本文发现电针刺激足三里穴(ST36)可改善奥氮平诱导的肥胖及脂代谢紊乱,其机制通过抑制外侧隔核(LS)、伏隔核(NAc)和苍白球中AGRP+神经元活性,重塑肝脑轴代谢调控通路实现。
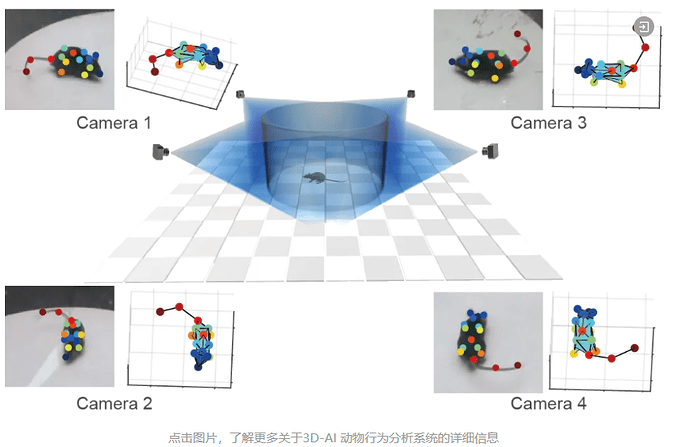
本研究论文应用了一湾生命科技(BAYONE)自主研发的 3D-AI 小鼠行为分析系统,解析奥氮平对小鼠精细行为的影响(图1)。一湾生命科技致力于通过 AI 技术,为脑科学及脑疾病研究等领域提供新一代更高效、更精准的仪器、软件、服务和标准。一湾生命科技专注于推动 AI 精细行为学技术在神经疾病模型的研究中发现新的生物标志物、表型鉴定及愈后评估等方面的应用。如果您对这一技术感兴趣,欢迎了解更多关于 BehaviorAtlas 3D-AI 动物行为分析系统 的信息!
BehaviorAtlas 3D-AI 动物行为分析系统是国内首家3D-AI精细行为学分析系统,可以在三维层面分析动物的精细行为;追踪16+个身体点,实现行为全面量化;提取40+种行为亚型,包括嗅探、梳理、跳跃等行为;计算100+种参数,捕捉动物行为的每一个细节;输出专业级可视化图表,满足SCI论文发表要求。目前,BehaviorAtlas 3D-AI 动物行为分析系统已经在大、小鼠、非人灵长类动物、犬类等模式动物上,针对自闭症、帕金森症、抑郁症、老年痴呆、脑出血等疾病模型以及精神类药物筛选上进行了多种应用。在此,我们也感谢 BehaviorAtlas 的用户对我们系统的关注和支持,希望 BehaviorAtlas 能够帮助更多的科研人员去解答生命科学中的难题。如果您希望深入了解其在动物行为研究中的应用,我们非常欢迎您进一步探索!
如果您对BehaviorAtlas 3D-AI动物行为分析系统感兴趣,欢迎通过公众号私信或扫描下方的微信二维码联系我们,我们将竭诚为您提供更多信息和帮助。
参考文献:
Chen J, Ju P, Luo C, Tu S, Sun Y, Shi S, Sun G, Huang L, Wang Z, Xu Y, Shi Y, Wu H. Effect of electroacupuncture at Zusanli reduced Olanzapine-induced lipid disturbances in mice via potential liver-brain interaction. FASEB journal : official publication of the Federation of American Societies for Experimental Biology.