本研究通过 AI 辅助的精细行为分析系统结合条件性恐惧记忆 范式 ,以及在体电生理、光/化学遗传学及 光纤 记录 等技术,系统阐明了 PTSD 早期 给予 S-氯胺酮可显著改善小鼠异常行为及恐惧记忆消退障碍,而晚期 S - 氯胺酮干预无治疗效果。本研究应用了一湾生命科技的 AI 精细动物行为分析系统——为核心机制的解析提供了关键技术支撑。
创伤后应激障碍(Post-traumatic stress disorder, PTSD)是由严重创伤事件引发的致残性精神障碍,以创伤事件后的几种症状为特征,典型表现包括侵入性回忆、持续回避、认知与情绪负性改变、过度警觉,并常合并自主神经紊乱及焦虑、抑郁等共病。现有首选药物选择性 5-羟色胺再摄取抑制剂(SSRIs),存在起效慢、疗程长、易致睡眠障碍等局限,临床获益大打折扣。近年来,以氯胺酮为代表的精神活性物质在PTSD治疗中展现出突破性潜力,在 PTSD 治疗中显示出潜力,但其抗 PTSD 效应呈显著时间依赖性,且机制尚不明确。
2025 年 9 月 25 日,空军军医大学西京医院麻醉与围术期医学科赵广超团队联合药学系吴玉梅团队在《Advanced Science》发表了题为 “ Time-Dependent Therapeutic Effect of S-Ketamine on PTSD Mediated by VTA-OFC Dopaminergic Neurocircuit ” 的研究论文。系统揭示了 S-氯胺酮治疗 PTSD 时间依赖性机制,并创新性地开发了靶向 OFC 脑区的无创时域相干脑刺激技术(temporal interference non-invasive brain stimulation, TI-NIBS),显著延长了 S-氯胺酮的有效治疗窗口。
本研究通过 AI 辅助的精细行为分析系统结合条件性恐惧记忆范式,以及在体电生理、光 / 化学遗传学及光纤记录 等技术,系统阐明了 PTSD 早期给予 S-氯胺酮可显著改善小鼠异常行为及恐惧记忆消退障碍,而晚期 S-氯胺酮干预无治疗效果。研究揭示,VTADA 神经元的兴奋性动态变化是决定 S-氯胺酮治疗成败的关键因素,早期 S-氯胺酮可逆转 VTADA 神经元活性抑制,并通过 VTADA - OFCCaMKII 神经环路发挥促恐惧消退作用。基于这一机制,研究团队开发了 TI-NIBS 技术,通过靶向刺激 OFC,增强皮层多巴胺传递,极大地拓展了 S-氯胺酮的有效治疗窗口。这一策略成功打破了“黄金 24 小时”治疗窗口的限制,为临床中错过早期干预时机的 PTSD 患者提供了新的治疗可能。
01 AI 行为评估:早期给予 S-氯胺酮能够缓解 PTSD 样行为
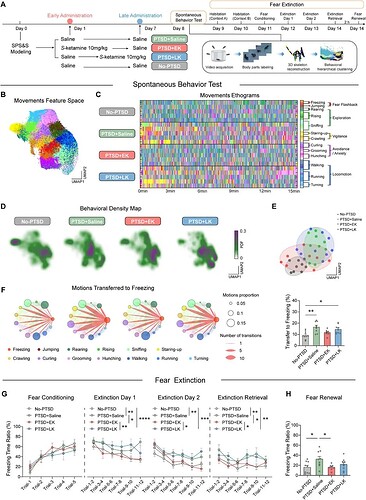
研究团队在小鼠中建立 PTSD 模型(SPS & S),分别在建模后第一天(早期干预,PTSD+EK 组)和第七天(晚期干预,PTSD+LK 组)给予 S-氯胺酮(图1A),并进行行为评估。
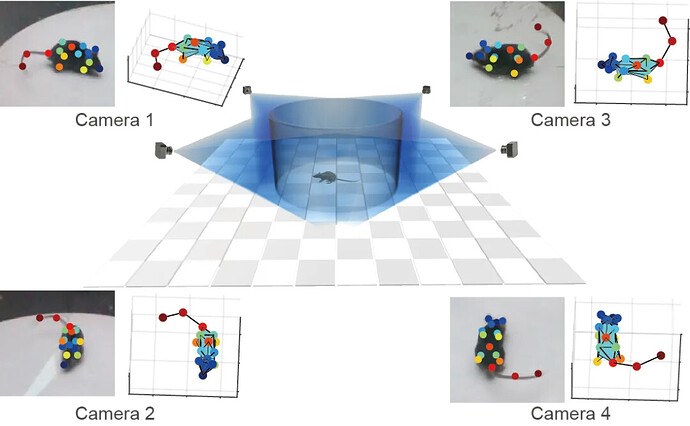
为了更客观、稳定地评估小鼠的自发行为,该研究结合人工智能辅助的 BehaviorAtlas 3D-AI 动物行为分析系统与经典的条件恐惧记忆行为范式,对 PTSD 小鼠行为表型进行了多维度、精细化解析。3D-AI 动物行为分析系统基于无监督层次聚类,识别出 40 种小鼠动作表型,并归类为 13 类行为特征,包括恐惧闪回(freezing、jumping)、探索(rearing、rising、sniffing)、警惕(staring-up、crawling)、回避/焦虑(curling、grooming、hunching)和运动(walking、running、turning)(图1B-C)。
研究者发现,PTSD 造模后导致小鼠的探索和运动相关行为减少,恐惧闪回和回避/焦虑相关行为增加。与造模后晚期(第 7 天)干预相比,早期(第 1 天)干预显著逆转了这些行为,使其更接近于正常小鼠(No-PTSD)(图1D-E)。通过分析动物行为间转换概率,发现 PTSD 小鼠表现出更高的向僵直行为转换的倾向,从而在传统诱发范式之外,为评估内源性恐惧记忆提供了新途径(图1F)。
随后,在恐惧消退实验中评估了小鼠的恐惧记忆消退能力,PTSD 小鼠表现出严重的消退障碍,早期干预显著恢复了其恐惧消退能力(图1G-H)。这些结果明确了 S-氯胺酮抗 PTSD 疗效具有时间依赖性,只有早期干预才能限制缓解小鼠 PTSD 样行为。
02 神经机制:VTADA 神经元兴奋性是治疗成败的关键
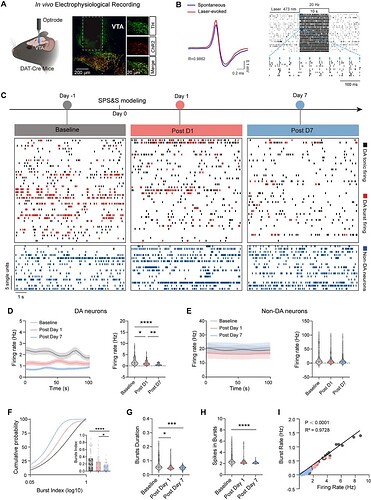
PTSD 的发生与 VTADA 神经元兴奋性的持续性降低密切相关,为了进一步研究创伤后 S-氯胺酮治疗 PTSD 的神经机制,研究者利用体内电生理来对 PTSD 发展过程中 VTA 多巴胺能(DA)神经元的电活动进行监测。
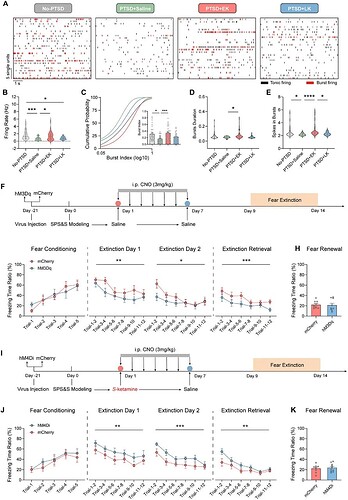
电生理记录显示,PTSD 造模后 VTADA 神经元的兴奋性及 burst 放电呈现进行性抑制(图2D-E),而同区域的 Non-DA 神经元活性则没有变化(图2F-H),提示 VTADA 特异性受损。
干预后的小鼠电生理结果显示,早期干预可显著恢复 VTADA 神经元放电频率和 brust 放电水平,晚期干预则不能(图3A-E)。有趣的是,研究者通过化学遗传学 DREADDs 技术,在 PTSD 发展过程中,人为地持续激活或抑制 VTADA 神经元,观察其对恐惧消退的影响(图3F)。PTSD 发展过程中激活 VTADA 神经元显著促进恐惧消退(图3G-H)。反之,在给予早期 S-氯胺酮治疗的同时,抑制 VTADA 神经元消除了 S-氯胺酮的治疗效果(图3I-K),阐明了 VTADA 神经元介导 S-氯胺酮治疗 PTSD 作用的时序依赖性。
03 环路机制:VTADA→OFCCaMKII 通路是 S-氯胺酮发挥作用的必要通路
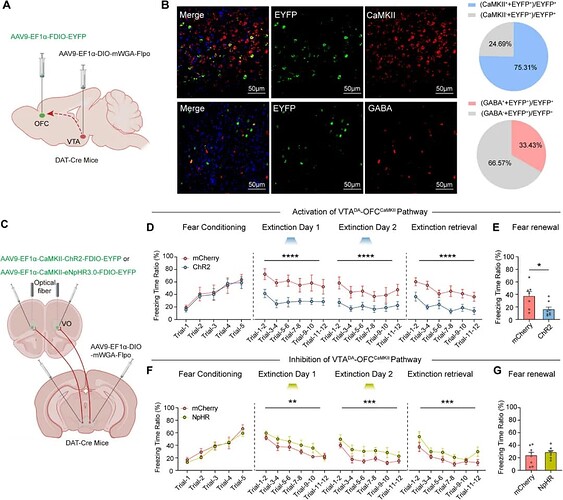
为了定位 VTADA 神经元的下游区域,研究者通过免疫荧光和病毒示踪发现, VTADA 神经元投射至 OFC 内 CaMKII 神经元(图4A-B)。通过光遗传特异性地调控 VTADA - OFCCaMKII 环路活性,光激活通路显著促进恐惧消退(图4D),反之,抑制该通路削弱了早期 S-氯胺酮的治疗效果(图4F),表明该神经环路是介导早期 S-氯胺酮促进恐惧消退的关键通路。
04 医学转化价值:TI-NIBS 无创脑刺激延长 S-氯胺酮有效时间窗
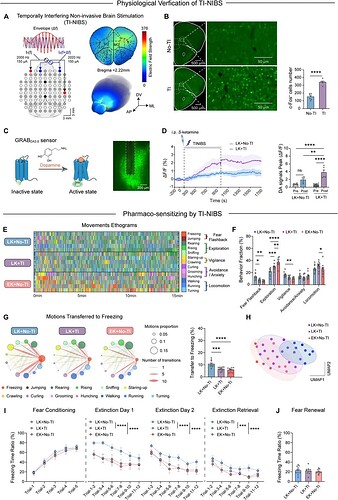
早期 S-氯胺酮干预固然有效,但晚期 PTSD 的治疗依旧难以实现。基于上述机制,研究团队开发了一种靶向 OFC 脑区的时域干涉非侵入性脑刺激(temporal interference non-invasive brain stimulation, TI-NIBS)技术,通过在头皮表面施加两个略有差异的高频电场,从而实现对 OFC 的精准、无创神经调控(图5A)。
c-Fos 免疫染色显示,TI-NIBS 可特异性激活 OFC 区域神经元(图5B),并且在晚期与 S-氯胺酮联用时,能够显著增强 DA 递质的释放(图5D)。 结合高精度的 3D-AI 动物行为分析系统与经典条件性恐惧记忆行为范式,全面考察 S-氯胺酮与 TI-NIBS 神经调控联合使用对 PTSD 小鼠异常行为表型的改善效果,发现 TI-NIBS 结合晚期 S-氯胺酮干预可显著改善自发行为异常与恐惧记忆消退障碍,拓宽了 S-氯胺酮在 PTSD 治疗中的有效时间窗(图5E-J)。
05 总结
综上所述,研究团队通过综合运用了多模态技术,系统地揭示了 S-氯胺酮治疗 PTSD 的时间依赖性 ,相比于晚期干预,早期干预才能有效改善 PTSD 小鼠的行为异常。其疗效机制在于逆转 VTADA 神经元活性的进行性抑制,恢复 VTADA - OFCCaMKII 环路功能。AI 辅助的 3D 精细行为分析系统为评估复杂精神疾病的动物模型提供了更客观、全面的指标,打破传统单一指标的局限。特别地,该研究还提供了一个可行的临床干预技术——TI-NIBS,有效激活 OFC 神经元,增强 DA 递质释放,打破药物固有的治疗时间窗限制。
文章中运用的 3D-AI 精细行为分析系统,是一湾生命科技(BAYONE)的创新产品——BehaviorAtlas 3D-AI 动物行为分析系统。除了开放旷场的自发行为分析,还适用于广泛的范式与造模,满足各种复杂精神疾病行为的研究需求。我们的产品还在许多优秀的研究工作中得到验证,如果您希望深入了解其在动物行为研究中的应用,我们非常欢迎您进一步探索!
为了帮助您获取更多信息,我们提供了便捷的联系方式。您可以通过公众号私信与我们交流,或者直接扫描下方的微信二维码,我们的专业团队将竭诚为您提供更多信息和帮助。
参考文献:
————————————————
Wang Y, Liu L, Wang J, et al. Time-Dependent Therapeutic Effect of S-Ketamine on PTSD Mediated by VTA-OFC Dopaminergic Neurocircuit. Adv Sci (Weinh). Published online September 25, 2025. doi:10.1002/advs.202500805