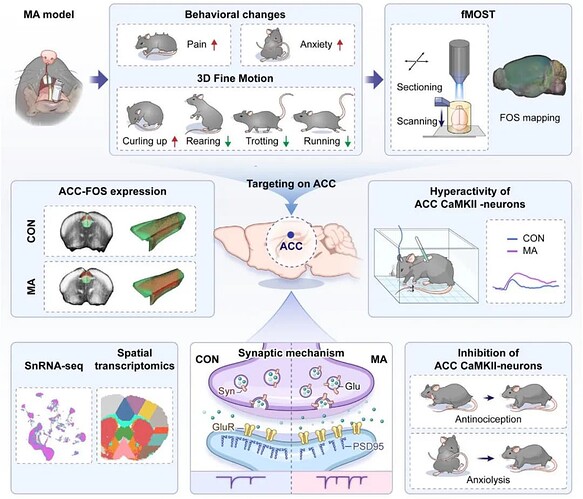
2025年9月,空军军医大学黄静等人在 Advanced Science 发表研究论文,阐明了 ACC 依赖 的 “牙颌面结构异常与慢性疼痛 - 情绪共病” 关联机制。在这项研究中,一湾生命科技(BAYONE)提供了自主研发的 BehaviorAtlas 3D-AI 动物行为分析技术支持,助力解析下颌骨不对称小鼠的精细行为动态变化 。
颅颌面结构异常,尤其是下颌骨不对称(mandibular asymmetry, MA),已被越来越多地认为是口面部疼痛及情绪共病的关键驱动因素,但其潜在神经机制仍不明确,这极大地阻碍了靶向治疗手段的研发。此外,目前尚无临床前研究将 MA 与纵向疼痛 - 情绪动态变化及全脑环路改变相关联,进而我们对这些病变发生发展的理解仍存在关键空白。
2025 年 9 月 24 日,空军军医大学黄静、Fan Ze 和空军军医大学口腔医学院金作林团队在 Advanced Science 在线发表题为 “Synaptic Dysfunction in the Anterior Cingulate Cortex Underlies Pain-Anxiety Comorbidity in a Mandibular Asymmetry Mouse Model” 的研究论文。该研究旨在建立临床前 MA 模型,以探究颅颌面结构缺陷与神经行为功能障碍之间的动态相互作用。
该研究中,纵向行为表型分析(包括纤毛机械刺激针实验以及开放场和高架十字迷宫测试)揭示了面部机械性痛觉过敏与类焦虑行为的不同阶段,计算行为学分析则揭示了自发性行为中细微但持续的改变。全脑活动图谱证实了前扣带皮层(anterior cingulate cortex, ACC)是诱导神经元激活的关键枢纽,而针对 ACC 的多组学分析揭示了该区域内细胞类型特异性的转录变化和突触重组,功能研究(包括稀疏标记、电生理学、蛋白质印迹和化学遗传学)表明,ACC调节同时调节疼痛和焦虑。研究整合多组学、环路水平及行为学研究方法,不仅阐明了 ACC 依赖的 “牙颌面结构异常与慢性疼痛 - 情绪共病” 关联机制,更为理解解剖异常相关神经功能障碍提供了一个系统性研究思路。
01 系统分析 MA 诱导的多维度行为表型
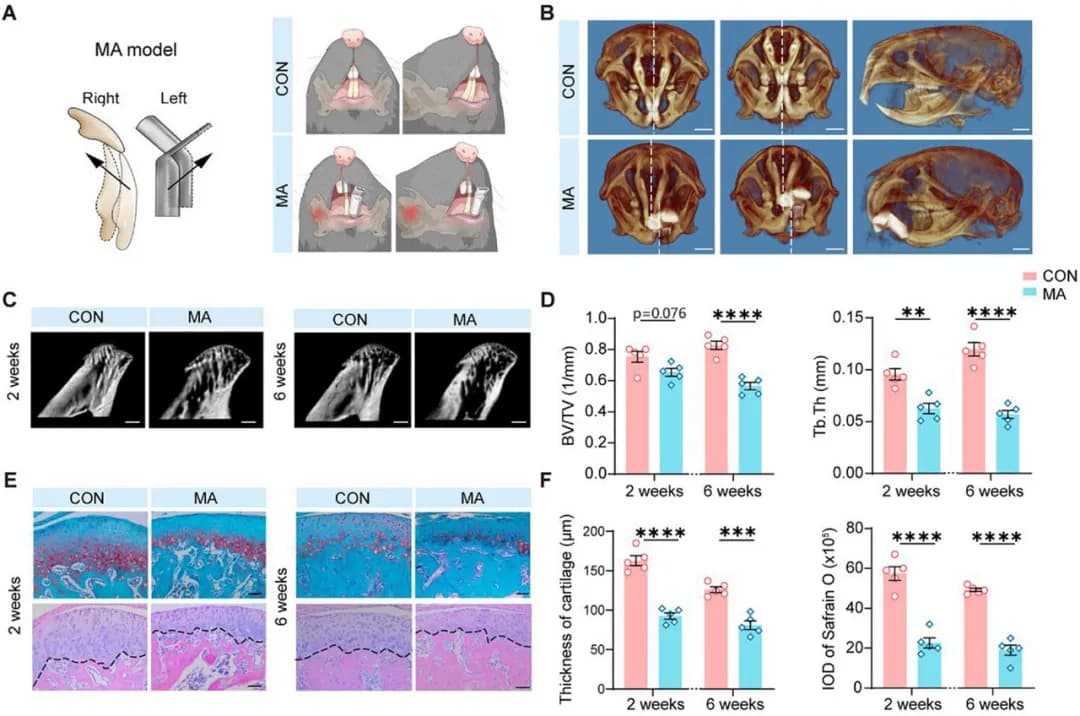
< 构建临床前 MA 小鼠模型 >
研究人员在小鼠口腔内植入定制口腔装置以破坏正常牙合关系,构建单侧后牙反牙合模型(图 1A)。研究在模型建立后 2 周时,通过计算机断层扫描(CT)三维重建发现:与对照组(CON)相比,MA 组小鼠表现出严重的下颌骨不对称症状(图 1B);在模型建立后 2 周和 6 周时,通过显微 CT 观察发现:MA 组小鼠的骨小梁结构均出现改变(图 1C);且发现 MA 组小鼠软骨组织损伤这一典型病理特征。这些结果直接或间接证实了模型复现 MA 的病理有效性。
< 疼痛 - 焦虑共病 >
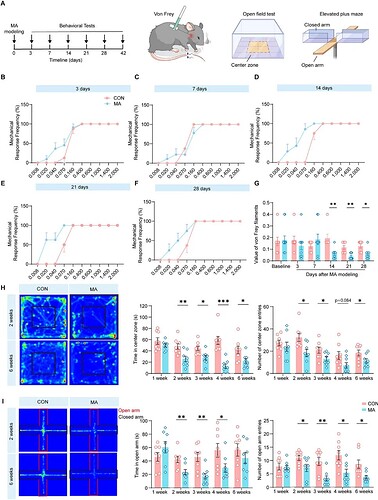
病理改变最终会表现为行为异常,该研究首先采用 Von Frey 测试评估小鼠的痛觉敏感性,发现 MA 模型导致小鼠出现持续性机械痛觉过敏 ,体现慢性疼痛行为表型(图 2A-G)。
为了探究慢性疼痛对情绪行为表型的影响,研究通过旷场试验和高架十字迷宫试验评估 MA 组小鼠的焦虑水平。行为学结果显示:在旷场试验中,MA 组小鼠在中央区域的停留时间缩短、进入次数减少,总移动距离及中央区域移动距离均降低(图 2H);在高架十字迷宫试验中,MA 组小鼠在开放臂的停留时间、进入次数及移动距离均显著少于对照组,但总移动距离无显著差异(图 2I)。这些结果表明 MA 组小鼠表现出明显的类焦虑表型。
为排除性别因素对模型结果的干扰,研究对雌性和雌性 MA 小鼠重复上述行为测试,均表现出一致的类焦虑行为。
< 多尺度自发行为 >
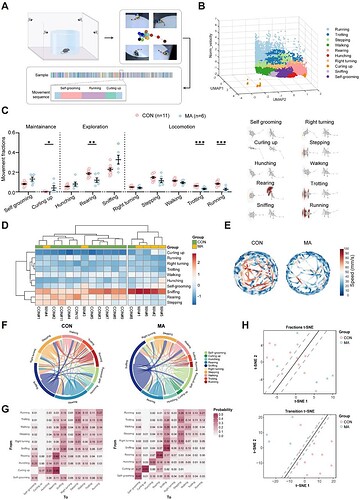
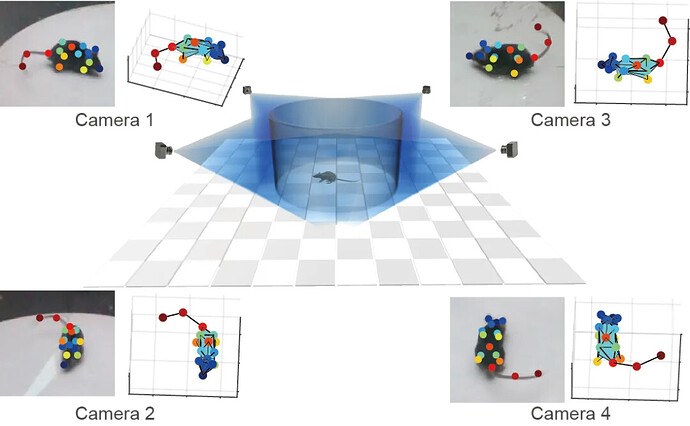
研究采用可保留层级行为动态的平行多层三维运动捕捉框架 ,通过连续多视角运动学监测对 MA 组与 CON 组小鼠的跨尺度行为模式进行定量分析(图 3A)。研究人员从 17 只小鼠中识别出 10 种主要自发行为,根据运动模式分为三类:维持行为(理毛、蜷缩);探索行为(弓背、直立、嗅闻);移动行为(奔跑、快步走、踏步、行走右转)。总体而言,与 CON 组相比,MA 组小鼠对新环境的探索意愿降低,且常呈现蜷缩的防御姿态,这也反映出其焦虑情绪(图 3B,C)。
基于 10 种行为的占比进行层级聚类,结果显示 MA 组 4 个样本的行为模式高度相似,而 CON 组多数样本聚为另一类(图 3D)。各组平均速度轨迹图也显示,MA 组的移动速度和位移距离均低于 CON 组(图 3E)。弦图与热图显示:CON 组的行为转换更灵活,半数蜷缩行为会转换为直立行为,体现其积极的探索态度;而 MA 组中多数行为均以自过渡(self-transition )为主,即行为状态经历短暂波动后重新回归初始状态,表明 MA 组小鼠倾向于维持现有行为(图 3F-G)。
为对比 MA 组与 CON 组的行为模式,研究基于行为占比和行为转换概率数据对样本进行降维分析,并通过支持向量机(SVM)分类(图 3H)。结果显示基于行为转换概率的分类效果更优,表明两组小鼠的行为模式存在显著差异,尤其是在行为转换逻辑 方面。
综上,多尺度行为分析表明,MA 建模降低了小鼠的探索驱动力、增加了防御姿态,并破坏了行为序列模式,证实其自发行为层级发生根本性重构,这与临床慢性疼痛状态下的焦虑相关共病特征一致。
< MA 模型的特异性 >
研究将 MA 模型与另一种常见的口面部疼痛模型(三叉神经痛模型)进行系统性比对,从疼痛定位、进食情况和模型面部参数三个核心差异表明了 MA 模型呈现出颞下颌关节紊乱病(TMD)特异性的病理生理特征,为后续研究 MA 相关 TMD 的独特机制 提供了模型特异性依据。
综上,此研究通过病理层面、行为层面和模型特异性验证,成功构建并表征了实验所需的 MA 小鼠模型。
02 阐明 ACC 依赖性机制
< 锁定 ACC 为 MA 相关神经紊乱的关键脑区 >
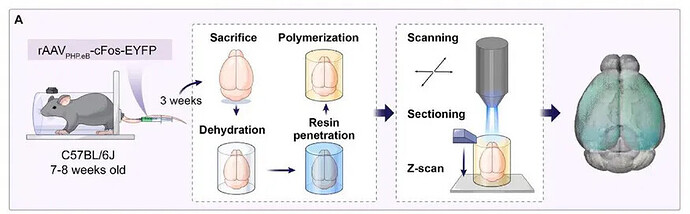
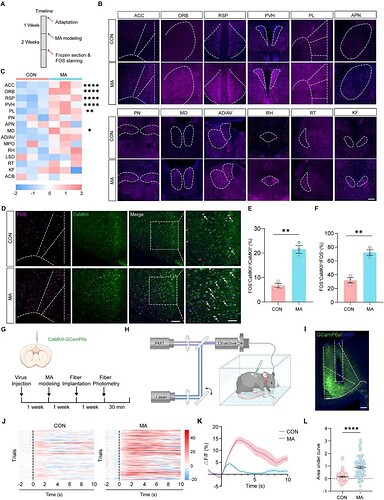
研究采用病毒标记,结合荧光微光学切片断层扫描(fMOST)实现对小鼠全脑神经元激活模式的定量分析(图 4A)。全脑活动图谱的分析结果表明 MA 引发的慢性疼痛并非仅影响局部脑区,而是导致全脑级别的神经活动紊乱 。而在所有激活脑区中,ACC 的 FOS-EYFP 神经元密度升高最显著,且这一结果与现有研究中 ACC 的已知功能高度一致。为进一步验证 ACC 的核心地位,研究对全脑激活图谱进行无偏分析,激活模式热图、分类器权重、特征协方差矩阵及累积激活贡献曲线均证实,ACC 是区分 MA 组与 CON 组的主要贡献脑区。
对 FOS 表达进行全脑图谱的实验流程图
通过 FOS 免疫荧光染色验证,再次确认 MA 组在包含 ACC 在内的多个脑区的激活显著强于 CON 组(图 5A-C),为 fMOST 结果提供交叉验证。随后研究进一步聚焦 ACC,对 ACC 进行细胞类型特异性分析发现:MA 组中 FOS 与 CaMKII⁺ 神经元的共定位显著增强(图 5D-F)。这一选择性激活提示,ACC 中的兴奋性投射神经元可能是介导 MA 相关疼痛 - 焦虑信号的核心细胞群。进一步研究 MA 组内 ACC 中 CaMKII⁺ 神经元的功能变化,研究分析梯度 Von Frey 刺激下的钙信号,结果显示:相同强度的伤害性刺激下,MA 组 ACC CaMKII⁺ 神经元的钙响应显著强于 CON 组(图 5G-L)。这表明 MA 不仅使 ACC CaMKII⁺ 神经元基础活性升高,还使其对伤害性刺激的敏感性增强,进一步证实该细胞群的功能异常。
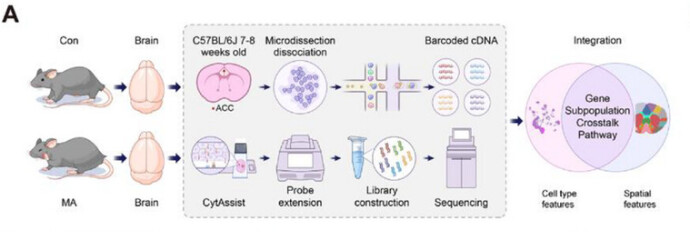
整合多组学分析揭示 MA 模型小鼠 ACC 的基因表达、细胞间相互作用及信号通路动态变化
为了获得更全面的基因表达图谱,以描绘 CON 组和 MA 组小鼠 ACC 中基因表达的空间分布和细胞特异性,研究人员对空间转录组学(ST)和单细胞测序数据进行了联合分析(图 6)。
ST 数据分析结果显示:ACC 与次级运动皮层、初级运动皮层之间具有更高的相似度和更近的分布。进一步通过 Loupe 局部判别算法筛选出 MA 组 ACC 的差异基因:Etnppl、Ptdgs、Junb、Nr4a1、Dbp(上调)与 Atp6v0a1、Sarnp、Arhgap32、Stmn1、Fabp7(下调)。研究结果为 MA 相关分子机制提供候选靶点。
单细胞测序的结果根据先前报道的标记基因,注释出包含谷氨酸能神经元在内的 9 种主要的细胞簇亚型。研究发现不同细胞亚型的差异基因数量存在显著差异,且谷氨酸能神经元被进一步细分为14个亚群,并且基因的上调和下调模式在不同的谷氨酸能神经元亚群中存在差异。此外,对谷氨酸能神经元的通路富集分析显示,与核糖体和蛋白质合成相关的关键通路表达上调,主要包括细胞质翻译、胞质核糖体和核糖体的结构组成。然而,与突触功能相关的通路,如突触结构或活性、突触组织和突触后特化,则显著下调。
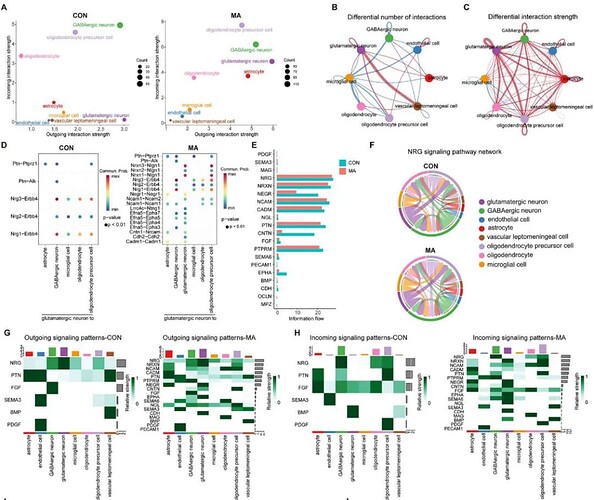
单细胞测序分析显示:MA 组谷氨酸能神经元的传入和传出信号强度均显著高于 CON 组(图 7A),提示该细胞群的信号交流更活跃。为了探究细胞簇之间的相互作用,研究基于 ACC 神经元的单细胞测序数据和空间转录组数据进一步通过 CellChat 工具分析细胞间交互,发现:MA 组中,谷氨酸能神经元与血管软脑膜细胞的交互显著减少(图7B),而谷氨酸能神经元与星形胶质细胞的交互、谷氨酸能神经元自身的交互显著增强(图 7C)。
研究利用 ST 数据集确定了细胞间相互作用的空间坐标。通过整合 snRNA-seq 数据,识别出参与这些相互作用的特定细胞。通过 stLearn 计算 ACC 中配体 - 受体(L-R)基因的空间共表达,发现:CON 组中的谷氨酸能神经元与其他簇的 L-R 对表达更为富集,尤其是 Nrxn3-Nlgn1(调控突触稳定性与可塑性)(图 7D)。
研究构建了 NRG、PTN 和 SEMA3 的信号通路网络,结果显示,与 CON 组相比,MA 组中的输入和输出信号模式显著更丰富。此外,还观察到在 CON 组中,NRG 信号通路在谷氨酸能神经元的输入和输出信号中均高度富集。然而,在 MA 组的输出信号模式中,该通路显著减少,这表明 MA 模型的建立导致了突触调控功能和突触可塑性的改变(图 7E-H)。
< MA 模型中 ACC 兴奋性突触的结构与功能可塑性 >
此研究进一步探究 MA 对 ACC 区中 CaMKII⁺ 神经元突触结构和功能的影响,结果揭示 MA 导致 ACC 兴奋性突触过度增生但结构紊乱,兴奋性信号过度。为了探究 ACC 区的这些可塑性变化是否由疼痛驱动,研究人员对 MA 模型小鼠进行镇痛处理,结果表明:MA 模型小鼠的行为异常及 ACC 区突触可塑性改变依赖于慢性疼痛。此外,为了探究 MA 模型小鼠的 BLA 激活情况,研究人员结合光遗传学与电生理记录技术开展实验,结果表明:MA 小鼠 BLA-ACC 通路神经元的突触前神经递质释放概率增强,同时伴随 BLA-ACC 通路突触前过度激活,进而导致兴奋性传递失衡。
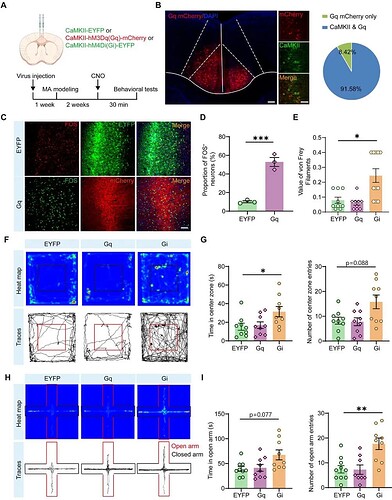
< 抑制 ACC CaMKII⁺ 神经元可缓解 MA 模型的疼痛 - 焦虑共病 >
研究通过化学遗传学技术,分别实现对 ACC 区 CaMKII⁺ 神经元的激活与抑制(图8 A-D),随后进一步分析不同组小鼠的行为表型。Von Frey 测试显示:Gi 组(抑制 ACC CaMKII⁺ 神经元)的痛阈显著高于 EYFP 组(对照)和 Gq 组(激活 ACC CaMKII⁺ 神经元)(图 8E)。旷场试验显示:Gi 组在中央区域的停留时间显著增加(图 8F-G);高架十字迷宫试验显示:Gi 组进入开放臂的次数显著增加(图 8H-I),且中央区域 / 开放臂的移动距离占比升高。这些研究结果表明,抑制 ACC 区 CaMKII⁺ 神经元的活性可有效减轻 MA 模型小鼠的机械痛觉过敏及共病焦虑症状。 不过,ACC 区及其下游靶区在 MA 致痛与焦虑共病中的具体作用机制,仍有待未来研究进一步探索。
03 讨论
此研究旨在阐明 ACC 神经元在 MA 模型小鼠口面部疼痛中的作用。通过行为学检测,研究观察到 MA 模型小鼠的痛觉感知、焦虑样行为及自发行为均发生改变;借助 fMOST 与 FOS 蛋白脑区定位技术,发现 ACC 神经元存在过度激活;随后采用光纤 photometry 记录、多组学分析、蛋白质印迹及电生理记录等一系列功能研究技术,验证了 ACC 神经元在细胞类型与突触功能上的变化;最终以 ACC 为靶点,通过化学遗传学技术调控 MA 模型小鼠的行为异常(图 9)。
小鼠疼痛与焦虑的潜在机制示意图
既往研究的行为分析多局限于单一时间点评估,无法捕捉疼痛与情绪障碍的动态发展过程;且尽管既往研究采用了传统行为学范式(如 Von Frey 测试、高架十字迷宫实验、旷场实验),这些方法虽能提供有价值的信息,但存在一定局限性 —— 缺乏对更自然环境下自发行为的分析,而自发行为分析更贴近临床症状表现。为解决这些局限,此研究采用基于机器学习的行为学分析方法,解析 MA 模型小鼠的自发行为模式 :观察到理毛行为(应激与不适的标志)与蜷缩姿势(疼痛相关防御行为的标志)呈增加趋势,同时探索行为与活动能力下降;值得注意的是,需要颌颈协调运动的小跑与奔跑行为减少,提示口面部不适可能导致功能损伤。这些精细的行为特征不仅反映了 MA 模型小鼠的自发性疼痛与情绪功能障碍,也为该模型提供了更全面、更具临床相关性的行为学图谱。
04 总结
本研究确立了 MA 作为 TMD 相关慢性疼痛与焦虑的临床前模型,揭示了 ACC 过度激活与突触可塑性在介导这些共病中的关键作用。纵向行为学分析与多层面组学分析表明,颅面部结构缺陷可驱动适应性不良的神经重构,表现为 ACC 区 CaMKII⁺ 神经元兴奋性升高、转录谱改变及突触可塑性增强。功能干预实验证实,调控 ACC 活性可同时缓解疼痛与焦虑样行为,凸显其在疼痛 - 焦虑共病中的核心作用。这些发现为颌面解剖异常与神经行为功能障碍之间建立了机制关联,确立了 ACC 作为 TMD 及相关口面部疾病神经调控治疗关键靶点的地位。
05 Bayone 助力科研
该研究论文应用了一湾生命科技(BAYONE)自主研发的 3D-AI 小鼠行为分析系统 ,为 MA 模型小鼠自发行为的精细化研究提供了重要工具支撑。一湾生命科技致力于通过 AI 技术,为脑科学及脑疾病研究等领域提供新一代更高效、更精准的仪器、软件、服务和标准。一湾生命科技专注于推动 AI 精细行为学技术在神经疾病模型的研究中发现新的生物标志物、表型鉴定及愈后评估等方面的应用。如果您对这一技术感兴趣,欢迎了解更多关于 BehaviorAtlas 3D-AI 动物行为分析系统 的信息!
BehaviorAtlas 3D-AI 动物行为分析系统是国内首家3D-AI精细行为学分析系统,可以在三维层面分析动物的精细行为;追踪16+个身体点,实现行为全面量化;提取40+种行为亚型,包括嗅探、梳理、跳跃等行为;计算100+种参数,捕捉动物行为的每一个细节;输出专业级可视化图表,满足SCI论文发表要求。 目前,BehaviorAtlas 3D-AI 动物行为分析系统已经在大、小鼠、非人灵长类动物、犬类等模式动物上,针对自闭症、帕金森症、抑郁症、老年痴呆、脑出血等疾病模型以及精神类药物筛选上进行了多种应用。在此,我们也感谢 BehaviorAtlas 的用户对我们系统的关注和支持,希望 BehaviorAtlas 能够帮助更多的科研人员去解答生命科学中的难题。如果您希望深入了解其在动物行为研究中的应用,我们非常欢迎您进一步探索!
如果您对BehaviorAtlas 3D-AI 动物行为分析系统感兴趣,欢迎通过公众号私信或扫描下方的微信二维码联系我们,我们将竭诚为您提供更多信息和帮助。
参考文献:
————————————————
Zhang Z, Zhang Y, Si J, et al. Synaptic Dysfunction in the Anterior Cingulate Cortex Underlies Pain-Anxiety Comorbidity in a Mandibular Asymmetry Mouse Model. Adv Sci (Weinh). Published online September 24, 2025. doi:10.1002/advs.202509509