一个专注于“动物模型构建”的多元合集。
肝癌是全球范围内高发的恶性肿瘤之一,根据 GLOBOCAN 2022 年数据,肝癌在全球癌症发病率中位列第六,全球每年新发病例达到 86.5 万例,约占所有癌症新发病例的 4.3%。在死亡率方面,肝癌位列第三,全球死亡病例达到 75.8 万例,占所有癌症死亡病例的约 7.8% 。肝癌疾病对我国负担尤为突出,2022 年数据显示中国肝癌新发病例为 36.8 万例,占全球病例的 42.5%;死亡病例为 31.7 万例,占全球病例的 41.8%。中国肝癌发病率在所有恶性肿瘤中位居第五,死亡率位居第三,从性别来看,男性发病率约为女性的 3 倍。
因此,研究肝癌的发病机制、药物筛选及疗效评估尤为重要,其中肝癌动物模型的构建首当其冲目前,肝癌动物模型的构建方法主要包括化学诱导、基因工程修饰和肿瘤移植,每种方法各有其特点和适用场景。
一、化学诱导肝癌模型
化学诱导肝癌模型是借助向实验动物投喂或注射特定化学致癌剂的方式,模拟人类肝癌的自然发生进程。此类模型操作简便,成本低廉,能较好地模拟人类肝癌的病理进程。
常用化学诱导剂包括:
DEN(二乙基亚硝胺):最为常用的化学诱导剂之一。在大鼠模型中,以 0.25% 的 DEN 水溶液按 10mg/kg 体重进行灌胃,每周一次,其余时间让大鼠自由饮用 0.025% 的 DEN 水溶液,4 周后停止供应含 DEN 的水,改供灭菌自来水 4 周,至第 18 周末,诱癌成功率可达 100%。Takeki Uehara 等利用 DEN 和 CCL4(四氯化碳)建立小鼠肺纤维化模型,并在动物 5 月龄时成功诱导动物成为肺癌模型。
AFB1(黄曲霉素 B1):将 AFB1 添加到饲料中进行定量投喂,如采用含 AFB1 4 - 5μg 的饲料连续喂养大鼠 6 周,至 90 天后诱癌率接近 100%。AFB1 诱发的肝癌模型中,癌前病变的肝细胞增生以透明细胞灶较为多见,但伴发肝硬化的程度较轻。
其他诱导剂:还涵盖 DAB(二甲基氨基偶氮苯)、2AAF(2 - 乙酰氨基酸)和 CCL4(四氯化碳)等。这些诱导剂通过不同机制对肝细胞 DNA 造成损伤,进而诱发癌变。
优点:
- 化学诱导模型能够较好地模拟人类肝癌的自然发生进程,涵盖肝细胞损伤、修复、代偿增生以及癌变等各个阶段。
缺点:
- 化学诱导过程相对较长,从开始投喂诱导剂到最终形成肝癌,往往需要数周甚至数月的时间,实验周期较长,实验过程中会发生动物死亡、感染等意外情况。
- 动物个体之间病灶的部位及数量不均一。
二、基因工程肝癌模型
基因工程肝癌模型是通过转基因技术,将特定的致癌基因导入实验动物体内,构建具有特定遗传背景的肝癌模型。这类模型能精确模拟人类肝癌的分子特征,对于研究肝癌的发病机制及靶向治疗具有重要意义。
常用转基因模型:
c-Myc/TGF-α 双转基因小鼠:能够显著缩短肿瘤发生周期,模拟人类肝癌的快速进展,17 周龄时肝脏发生假腺性肝细胞癌。
Mdr2(ABCB4)敲除小鼠:该基因编码一种胆汁运输蛋白,将此基因敲除后会使肝胆汁排泄产生障碍,从而引发肝脏炎症与损伤,最终致使肝癌发展与发生。Mdr2 敲除小鼠在出生 2 - 3 周后,会出现肝细胞损伤、血管扩张以及导管增生的表型,8 - 9 周后,小鼠会有肝纤维化症状出现,16 个月后,多数小鼠会发生肝癌病变。
优点:
- 基因工程模型能够精准模拟人类肝癌的分子特征,涵盖基因突变、信号通路异常等方面。
- 模型稳定性良好,可重复性较强。
- 适用于开展肝癌发病机制的研究以及靶向治疗药物的筛选工作。
缺点:
- 构建过程复杂,周期较长,成本较高。
- 该模型对实验动物的遗传背景和环境条件要求较高,轻微的遗传变异或环境因素改变都可能影响模型的表型和实验结果。
三、移植肝癌模型
移植肝癌模型是将人类或动物的肝癌细胞或组织移植到实验动物体内,构建荷瘤动物模型。这类模型操作简便,成瘤率高,适合抗肿瘤药物的筛选及疗效评估。
常用移植方法:
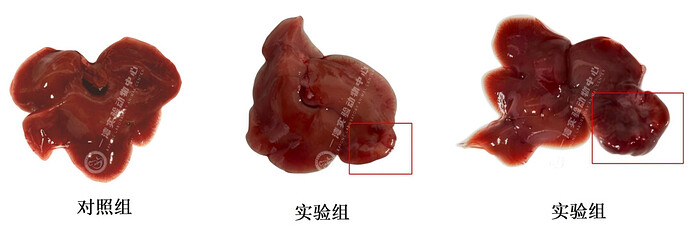
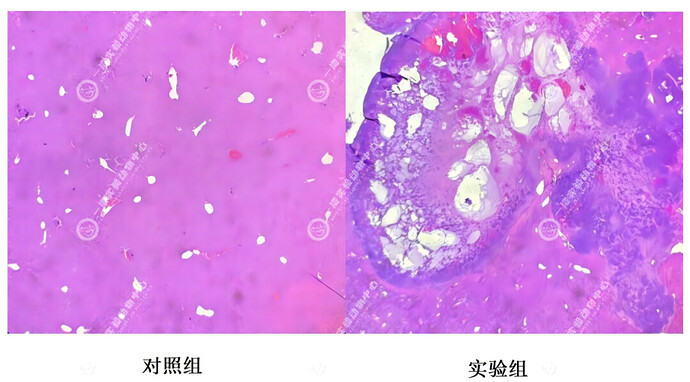
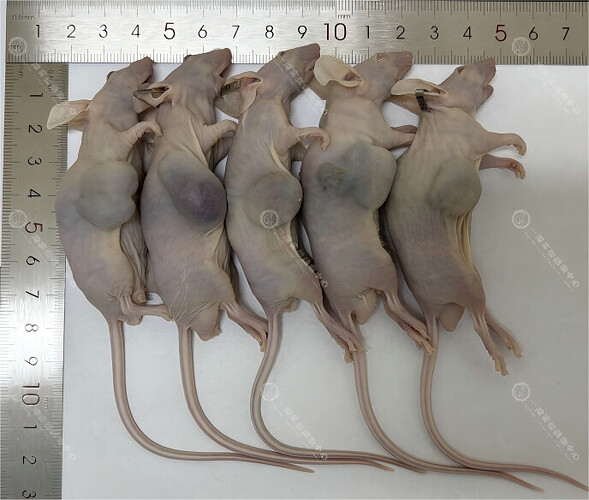
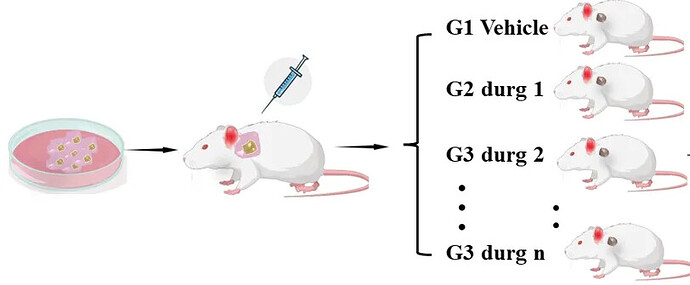
原位移植:将肝癌细胞或组织直接移植到实验动物的肝脏内,模拟肝癌的自然生长环境。一般地,可向 Balb/c nude 小鼠肝脏内注射 5×106 个 HepG2 细胞,构建原位肝癌模型(图 2)。手术两周后,可观察到动物肝脏有明显的肿块。对肝脏组织进行石蜡切片和 HE 染色,发现肿瘤区染色较正常组织深,肿瘤细胞呈长梭型,胞核大而圆,核染深,肿瘤组织内有丰富的微血管(图 3)。
异位移植:将肝癌细胞或肿瘤组织块移植到实验动物的皮下、腹腔等部位。例如,Balb/c nude 小鼠皮下注射 HepG2 细胞,构建皮下肝癌模型(图 4)。种瘤 10 天后,动物肿瘤体积达到 100mm3,随后可分组给药进行药效评估。
常用移植细胞系:
人源肝癌细胞系:如 HepG2、Huh7、Hep3B、PLC、MHCC97H、SMMC-7721、MHCC9-L 等,这些细胞系来源于人类肝癌组织,保留了人类肝癌的一些生物学特性。
鼠源肝癌细胞系:如 Hepa1-6、H22 等,这些细胞系来源于小鼠肝癌组织,适用于同源移植模型。
移植肝癌模型的特点:
- 移植肝癌模型操作简便,成瘤率高,适合大规模实验。
- 异位移植模型耗时短、费用低,但很少出现转移;原位移植模型肿瘤生长微环境与现实更相似,但操作更复杂且易出现转移。
- 适用于抗肿瘤药物的筛选及疗效评估,但可能无法完全模拟人类肝癌的复杂性和异质性。
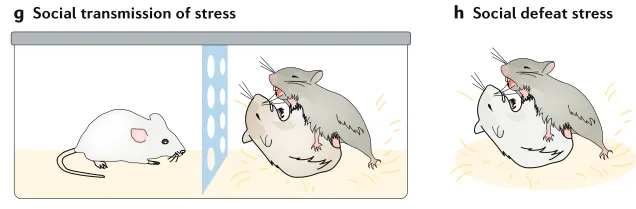
在精神疾病研究领域,如何精准模拟人类因长期社会压力诱发的抑郁、焦虑及社交回避行为,是科研工作者面临的关键挑战。慢性社交挫败应激模型(Chronic Social Defeat Stress,CSDS),通过模拟社会竞争中的心理挫败,已成为研究应激性精神疾病机制及药物筛选的金标准工具之一。
一、CSDS 模型构建核心原理
CSDS 的核心科学价值在于,它超越了单纯的生理应激,通过精心设计的“社交竞争”情境,在小鼠身上成功诱导出与人类临床特征高度相似的心理创伤。
其理论基础深植于啮齿类动物稳定的社会等级和领地意识。当一只实验鼠(通常为 C57BL/6J)被反复引入一只有强烈攻击性的 resident 鼠(如 CD-1)笼中时,它会持续经历身体威胁、心理挫败及社会地位丧失。这种复合应激能可靠地引发长期的行为与生理改变。
关键革新:个体差异的表征
CSDS 模型的高级之处在于,它能自然地区分出敏感鼠与抵抗鼠。这种分群能力使得研究者不仅能探讨疾病的“脆弱性”,还能深入研究天然的“心理韧性”机制,为寻找新的治疗靶点提供了独一无二的窗口。
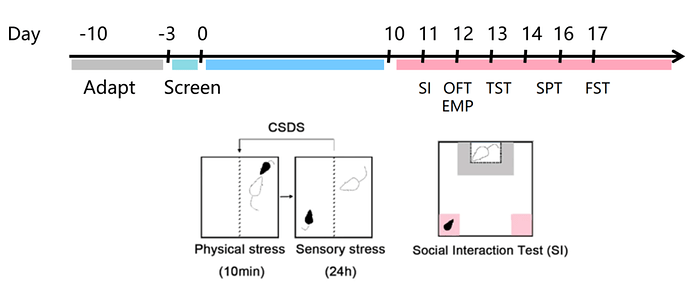
二、CSDS 模型标准化构建流程
一个严谨的 CSDS 造模流程,包含三个核心环节,确保模型的可重复性与稳定性。
1. 攻击鼠的筛选与标准化
- 目的:确保攻击源(CD-1)具有稳定、可靠的攻击性,是模型成功的前提。
- 操作:将陌生的 C57BL/6J 小鼠引入单养的 CD-1 雄鼠笼内,观察 10 分钟。
- 标准:要求 CD-1 鼠在连续 3 天的测试中,每次接触对方后必须在 2.5 分钟内发起攻击,否则予以淘汰。
2. 慢性社交挫败应激的实施
- 物理接触阶段(5-10 分钟):将实验鼠放入攻击鼠笼内,让其自由接触,直至 C57 鼠表现出稳定的屈服姿态(如仰卧、僵立不动)。
- 心理威胁阶段(24 小时):随后,实验鼠和 CD-1 小鼠共同饲养在同一个笼盒内,但居住地用带孔的透明隔板将其隔开。实验鼠虽免受直接攻击,但视觉、听觉和嗅觉各个感官层面上仍暴露于“施暴者”的威胁,从而心理应激亦持续强化。
- 循环与适应:此流程每日重复,并每日更换不同的攻击鼠,以防止实验鼠产生习惯化,确保应激的强度和新鲜感。
3. 核心行为表型:社交互动测试(Social Interaction Test,SIT)
将 CD-1 小鼠置一旷场中。第一阶段,金属网笼中无目标鼠,将 C57BL/6 小鼠置旷场中 2.5 min;第二阶段,在金属笼中放入 1 只 CD1 小鼠,再将 C57BL/6 小鼠放回旷场中 2.5 min。拍摄记录小鼠在社交互动区以及角落区的时间,社交互动比率为:第二阶段在互动区的时间/ 第一阶段在互动区的时间。认为 SI<1 的小鼠表现出社交回避为敏感型,SI≥1 的小鼠表现出社交偏好为抵抗型。
三、CSDS模型多维度的表型评估体系
在 CSDS 研究中,行为表型的变化需通过与神经内分泌和分子层面的数据相互印证,才能揭示其内在机制。因此,一套融合了此三个维度的评估体系,是构成一项深入研究的核心。
一湾实验动物中心已在神经科学领域建立了稳定可靠的一站式技术服务平台,致力于为客户提供覆盖神经科学基础研究及神经系统疾病临床前药效评价的全流程解决方案。平台具备多种常用神经系统疾病动物模型的构建能力,涵盖抑郁症、焦虑症、脑卒中、帕金森病、孤独症及阿尔兹海默症等大小鼠模型。同时,我们提供全面的动物行为学检测服务,包括认知功能、运动功能、痛觉反应、焦虑与抑郁样行为以及嗅觉功能等一系列标准化行为范式评估。
四、前沿洞察:CSDS 的神经机制
随着高通量测序、单细胞技术与化学遗传学的飞速发展,对 CSDS 模型的理解已从宏观行为表象,深入到分子与神经环路的精准调控机制。多项发表于 Advanced Science 、Research 等期刊的研究,揭示了新的关键分子与潜在治疗靶点。基于新机制,多种新兴干预策略正在被探索。
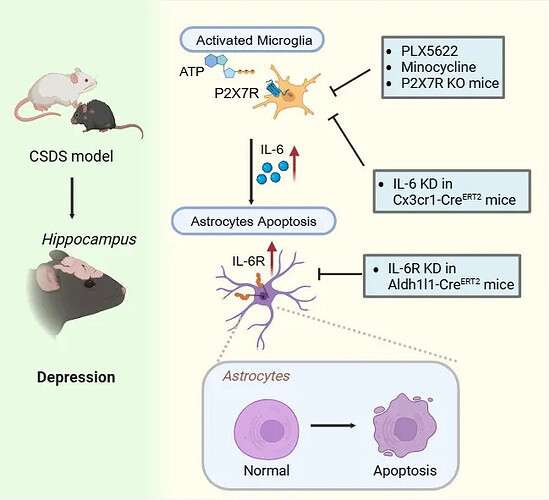
复旦大学俞瑾教授、张玉秋教授团队在 Advanced Science 上的研究发现,CSDS 应激后,海马区小胶质细胞被显著激活,并释放大量的白细胞介素-6(IL-6)。这些 IL-6 会作用于星形胶质细胞,触发其萎缩与凋亡,最终导致抑郁样行为的产生。该研究清晰地勾勒出“小胶质细胞 → IL-6 → 星形胶质细胞 → 行为表型”的因果链条。本项研究为临床治疗抑郁症提供了潜在靶点。
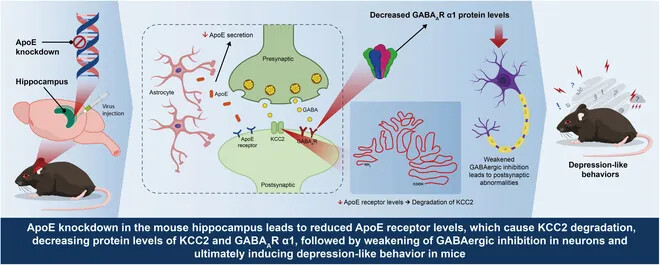
浙江省人民医院叶祥明教授团队与安徽医科大学合作在 Research 发表研究,首次揭示海马区 ApoE 通过调控 KCC2 表达维持 GABA 突触功能,进而影响应激诱导的小鼠抑郁样行为的可能分子机制。研究发现,CSDS 导致海马区 ApoE 表达下调,进而降低 KCC2 稳定性,损害 GABA 能抑制功能,诱发抑郁行为;而激活海马 GABA 能神经元、增强 KCC2 功能或过表达 ApoE 均可显著逆转上述病理表型。该研究阐明了 ApoE-KCC2 通路在抑郁中的关键作用,为抗抑郁药物研发提供了新靶点。
代谢性疾病的发病机制复杂,涉及遗传、营养、能量平衡等多重因素。选择一款能够精准模拟人类疾病病理特征的动物模型,是开展机制研究和药物评价的首要环节。
在选择模型前,必须明确以下三个核心问题:
1. 研究层级是什么?
- 基础机制探索:侧重于解析特定基因或通路的生理功能,需要高度可控的工具模型(如组织特异性基因敲除)。
- 病理模拟:旨在再现人类疾病多因素、渐进式的发展过程,要求模型具备较高的表型相似性(如饮食诱导模型)。
- 药效评估:核心在于预测人体反应,要求模型具备高度的预测效度和临床相关性(如复合模型或特定基因修饰模型)。
2. 关注哪种核心疾病?
- 如糖尿病、肥胖、非酒精性脂肪肝炎等疾病,不同疾病对应着不同的优选模型。
3. 需要哪些关键表型?
- 糖代谢:空腹血糖、糖耐量、胰岛素耐量。
- 脂代谢:血清脂谱、肝脏脂质沉积。
- 系统表型:体重体成分、血压、炎症水平等。
常见代谢性疾病模型
1、糖尿病模型
糖尿病的动物模型分为自发性、诱发性(手术诱导和化学药物诱导)、基因工程糖尿病动物模型。
1、1 型糖尿病模型
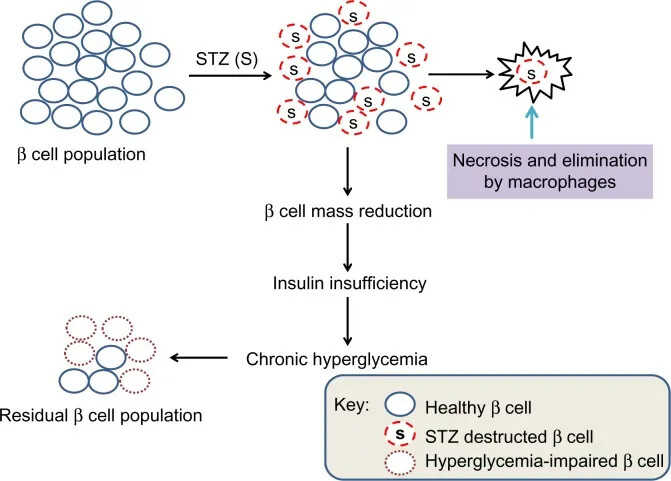
建模方法:通过腹腔注射链脲佐菌素(Streptozotocin, STZ),利用其 β 细胞毒性,选择性破坏胰腺胰岛 β 细胞,导致胰岛素分泌的绝对缺乏。
代表模型:
- 单次大剂量 STZ 模型 :在敏感品系(如 C57BL/6 小鼠、SD/Wistar 大鼠)中单次注射高剂量 STZ,快速、大量地破坏β细胞,诱导急性 1 型糖尿病。
- 多次小剂量 STZ 模型 :连续数天注射较低剂量的 STZ,通过累积的 β 细胞毒性和引发的轻微自身免疫反应,更模拟人类 1 型糖尿病的缓慢发病进程。
表型特征:“三多一少”症状(多饮、多食、多尿、体重下降);出现持续性高血糖和低胰岛素血症;若不加以治疗,动物将出现酮症酸中毒甚至死亡;长期可发展出糖尿病肾病、神经病变等并发症。
研究应用:主要用于研究 1 型糖尿病的疾病机制、评估胰岛素替代疗法的疗效、测试新的降糖药物、以及探索胰岛移植或 β 细胞保护/再生策略。
优势:
- 建模方法经典、操作简便、成本低、成模周期短(数天内)。
- 高血糖等表型显著且稳定,重复性好,非常适合大规模药物初筛。
- 多次小剂量法能部分模拟自身免疫性糖尿病的特征。
局限:
- STZ 对肝肾有已知毒性,可能在研究药物副作用时产生非特异性干扰。
- 成模率及严重程度对动物品系、年龄和状态敏感,存在个体差异。
- 其为化学诱导模型,与人类 1 型糖尿病由遗传和环境因素触发的、缓慢的自身免疫过程在病因上存在根本差异。
2、2 型糖尿病模型
建模方法:主要通过两种途径诱导:1. 饮食诱导:长期饲喂高脂饲料;2. 化学诱导:联合使用高脂饮食与低剂量链脲佐菌素(STZ)。此外,也包含多种自发性遗传模型。
代表模型:
- 饮食诱导肥胖模型 :C57BL/6J 小鼠等品系长期饲喂高脂饲料,诱导胰岛素抵抗和肥胖。
- 高脂饮食联合低剂量 STZ 模型 :先以高脂饮食诱导胰岛素抵抗,再以低剂量 STZ 轻度、部分破坏 β 细胞功能,模拟疾病核心病理。
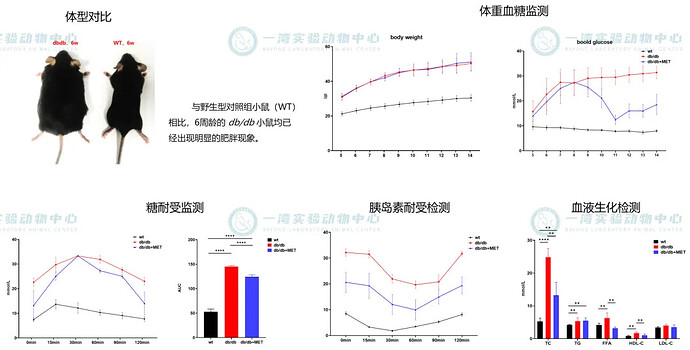
- 遗传模型 :如 db/db 小鼠、Zucker 肥胖大鼠等,因其瘦素受体缺陷,自发产生严重肥胖、胰岛素抵抗及高血糖。
表型特征:肥胖(饮食及遗传模型)、食欲亢进;核心特征为胰岛素抵抗和代偿性高胰岛素血症,随病程进展逐渐出现高血糖;后期可伴随 β 细胞功能衰竭,出现糖尿病并发症。
研究应用:主要用于研究胰岛素抵抗的发生机制、β 细胞代偿衰竭的过程、筛选胰岛素增敏剂(如二甲双胍、TZDs)等改善代谢的药物,以及探讨糖尿病并发症的病理机制。
优势:
- 高脂饮食+低剂量 STZ 模型能够较好地模拟人类 2 型糖尿病“胰岛素抵抗 → β 细胞功能减退”的自然病程,成本较低,应用灵活。
- 遗传模型表型稳定强烈,成模时间短,适用于大规模药物筛选。
局限:
- 饮食诱导模型成模时间较长,且表型严重度易受饮食配方和动物品系影响。
- 遗传模型的发病机制通常集中于单一基因通路,与人类多基因、多因素致病的异质性存在差距。
- 部分模型(尤其遗传模型)伴随极端的代谢紊乱,可能干扰对药物特异性作用的评估。
2、非酒精性脂肪性肝病模型
非酒精性脂肪肝动物模型可分为饮食诱导的肥胖模型【如蛋氨酸和胆碱缺乏(methionine-choline deficient, MCD)饮食】、化学物质【如四氯化碳(CCl4)】诱导的模型、遗传修饰的模型(如敲除特定基因的小鼠)等。
MCD 饮食诱导模型
建模方法:通过饲喂缺乏蛋氨酸和胆碱的合成饲料,破坏肝脏的脂质输出和 β 氧化过程,从而快速诱导肝脏脂质堆积、氧化应激及炎症。
代表模型:
MCD 饮食小鼠模型 :在 C57BL/6 等品系中应用最为广泛,能快速、稳定地诱导出 NASH 表型。
MCD 饮食大鼠模型 :同样可有效复制 NASH 核心病理特征,适用于需要更大样本量的研究。
表型特征:
代谢特征 :动物体重显著减轻,伴有肝重占比增加。
肝脏病理 :迅速发生肝脂肪变性、小叶内炎症及肝细胞气球样变。
关键进展 :在短期内(通常 4-8 周)即可出现明显的肝纤维化,这是该模型的核心优势。
研究应用:主要用于研究 NASH 向肝纤维化进展的核心机制、筛选和评估抗炎、抗氧化及抗肝纤维化药物的疗效。
优势:
- 成模周期短,病理特征典型且强烈,能高效复制 NASH 的核心三联征(脂肪变性、炎症、气球样变)及纤维化。
- 表型重复性好,成本相对较低,非常适合针对肝纤维化环节的药物筛选。
局限:
- 模型动物出现体重下降和全身性代谢改善(如改善外周胰岛素抵抗),这与绝大多数伴有肥胖和代谢综合征的 NASH 患者临床特征相悖。
- 其发病机制集中于肝脏本身的代谢障碍,无法全面模拟人类 NASH 的全身性代谢紊乱驱动病因。
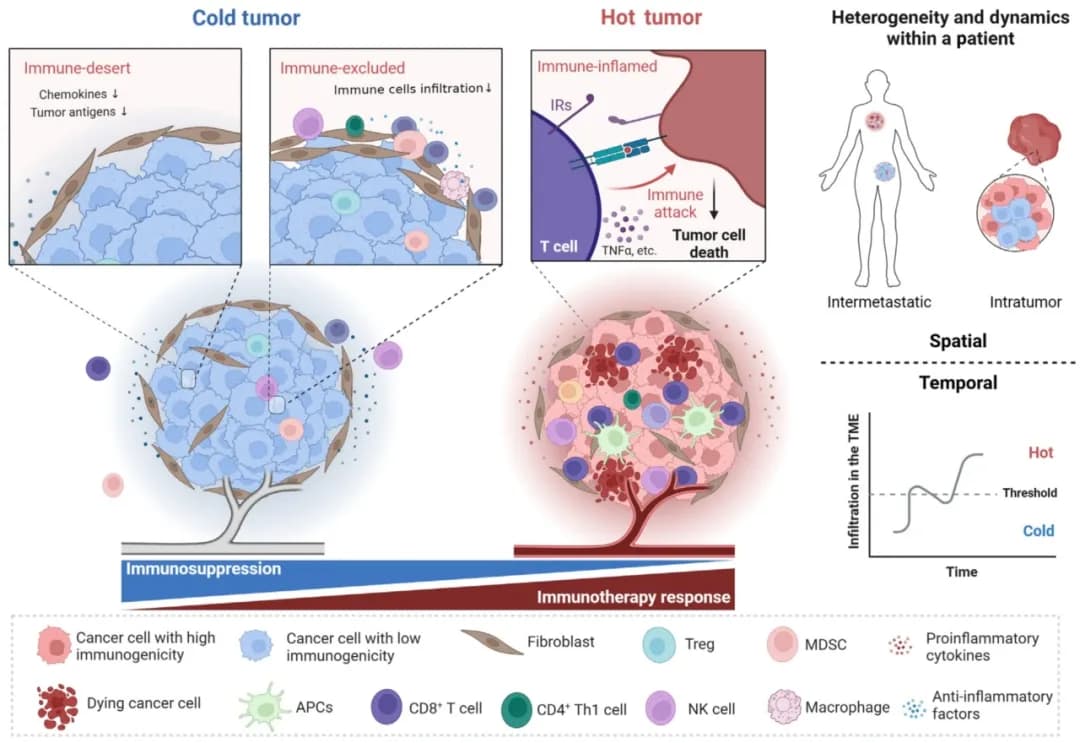
在肿瘤免疫药物的临床前研发中,体内药效评价的成败高度依赖于所选动物模型的适用性。当体外实验数据与体内结果出现显著差异时,其根源往往在于模型与治疗机制的错配。本文旨在系统阐述如何依据肿瘤的免疫特征(“热”与“冷”),为不同的免疫治疗策略甄选最适配的临床前动物模型,以提升实验数据的预测价值。
一、热”肿瘤和“冷”肿瘤的区别
肿瘤免疫微环境(Tumor Immune Microenvironment, TIME)的异质性是影响免疫治疗应答的关键因素。根据 T 细胞浸润程度及功能状态,可将其大致分为两类:
免疫浸润型(“热”肿瘤)
“热”肿瘤通常被定义为肿瘤微环境中存在大量免疫细胞浸润,尤其是效应 T 细胞高度富集,并且这些免疫细胞处于激活状态,能够积极识别并攻击肿瘤细胞。这类肿瘤往往具有较高的免疫原性,意味着它们能够更有效地引发机体的免疫反应。
免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICIs)的作用机制在于阻断此类信号,重新激活 T 细胞的抗肿瘤活性。
- 关键特征: 高水平的 T 细胞浸润,对 ICIs 潜在敏感。
免疫排斥型/沙漠型(“冷”肿瘤)
此类肿瘤表现为 T 细胞显著缺失或仅局限于肿瘤边缘。其微环境常由免疫抑制性细胞(如 M2 型巨噬细胞、调节性 T 细胞)主导,且可能存在物理屏障(如致密的纤维基质)或化学屏障(如缺乏趋化因子)。因此,ICIs 单药治疗在此类肿瘤中往往无效。
- 关键特征: 缺乏杀伤性 T 细胞浸润,对 ICIs 原发性耐药。
核心考量: 若一项旨在激活 T 细胞的研究(如 PD-1/PD-L1 抑制剂)选用了一个固有的“冷”肿瘤模型,其结果并不足以反映药物的真实效果。因此,基于治疗机制与肿瘤免疫微环境(TIME)特性的模型匹配,是临床前实验设计的首要原则。
二、肿瘤模型构建的技术路径与挑战
稳定、可靠地模拟人类肿瘤的免疫特征,是临床前研究的核心挑战。
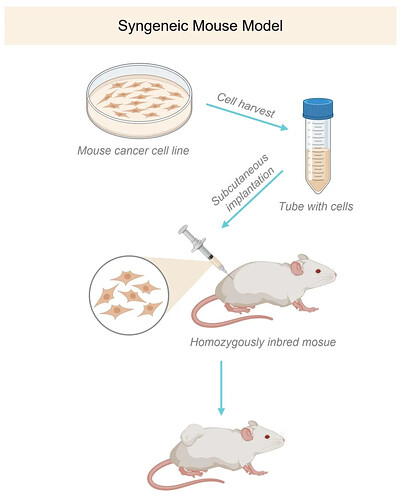
同源荷瘤模型(Syngeneic Model)
同种来源的肿瘤细胞系的同种移植模型,即一种将近交系的永生化小鼠肿瘤细胞系移植到免疫健全的相同近交系小鼠皮下或原位,使完整的鼠源免疫系统与同种肿瘤细胞相容,构建的一种免疫健全的鼠源肿瘤模型。
- 核心特征与应用:该模型保留了完整的鼠源免疫系统与肿瘤间的相互作用,是研究肿瘤免疫循环及免疫记忆的经典工具。因其通常具有较高的免疫原性,可作为“热肿瘤”模型,广泛应用于免疫检查点抑制剂的机制验证与初步筛选。
- 技术难点:确保模型免疫状态的稳定性与可重复性是关键挑战。
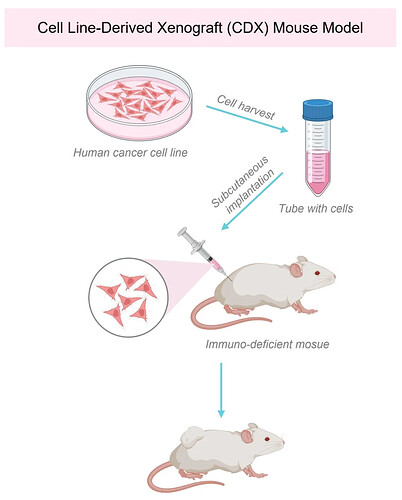
异源肿瘤模型(Cell Line-Derived Xenograft)
异种来源的肿瘤细胞系的异种移植模型,即一种将人源肿瘤细胞系移植到免疫缺陷型小鼠皮下或原位,使人源肿瘤细胞系在小鼠体内生长的一种肿瘤模型。
- 核心特征与应用:该模型能够模拟人体内免疫系统与肿瘤的特异性互作,是评估人源特异性药物(如免疫检查点抑制剂、CAR-T 细胞疗法)药效与安全性的“金标准”平台,尤其适用于在高度模拟人体的环境中研究“冷肿瘤”的转化与逆转。
- 技术难点:模型构建的成功高度依赖于人免疫系统重建的效率、各免疫细胞亚群的数量及移植物抗宿主病的有效控制。
三、模型匹配的策略框架
针对免疫检查点抑制剂
研究阶段:机制验证与初步筛选
- 推荐模型:同源荷瘤模型。
- 核心依据与优势:该模型系统保留了完整的鼠源免疫系统及免疫检查点分子(如鼠 PD-1/PD-L1),能够真实模拟药物、免疫系统与肿瘤三者间的相互作用。其周期短、成本效益高、成瘤规律性好,非常适合在研发早期进行大规模的药效初步验证、剂量探索以及联合用药方案的快速筛选。
研究阶段:临床前转化与桥接研究
- 推荐模型:人源化小鼠模型。
- 核心依据与优势:由于绝大多数 ICIs 具有严格的种属特异性,仅能识别并结合人源靶点。人源化小鼠模型通过重建功能性人免疫系统,为人源 ICIs 提供了其发挥作用的生理性环境。在此模型中获得的数据,能够更准确地预测药物在人体内的药效动力学、潜在疗效及免疫相关不良事件风险,是 IND 申报前最关键的支持数据之一。
针对过继性细胞疗法
研究阶段:体内药效与安全性评价
- 推荐模型:人源化小鼠模型。
- 核心依据与优势:CAR-T/TCR-T 等疗法的核心在于人源免疫效应细胞在体内对表达人源靶抗原的肿瘤细胞的识别与清除。人源化小鼠模型是唯一能同时支持人源肿瘤生长与人源免疫细胞(包括输入的 CAR-T 细胞)体内功能研究的临床前平台。它能够系统地评估 CAR-T 细胞的体内增殖动力学、向肿瘤组织的归巢能力、长期持久性、肿瘤杀伤活性以及可能引发的细胞因子释放综合征等安全性问题,是整个研发链条中不可或缺的金标准评价体系。
针对靶向肿瘤微环境的药物
研究阶段:药效评价与作用机制解析
- 推荐模型:经过严格验证的“冷”肿瘤模型(包括同源性或人源化低免疫原性模型)。
- 核心依据与优势:此类药物的作用机制并非直接杀伤肿瘤细胞或激活 T 细胞,而是旨在重塑免疫抑制性的肿瘤微环境。因此,选用内在表现为“冷”表型(如 T 细胞浸润匮乏、免疫抑制细胞富集、或存在物理/生化屏障)的模型是验证药效的前提。在这些模型上,成功诱导 T 细胞浸润、将“冷”肿瘤转化为“热”肿瘤,是证明药物作用机制的关键指标。该策略能有效去除非机制相关的干扰,为药物的开发提供最直接和令人信服的证据。
阿尔茨海默病(Alzheimer’s disease, AD)是世界上最常见的神经退行性疾病,作为占比高达 60%-80% 的痴呆症类型,它以进行性认知障碍与记忆衰退为核心症状。其核心病理特征包括 β-淀粉样蛋白(Aβ)斑块沉积、Tau 蛋白过度磷酸化形成的神经纤维缠结,以及神经突触的大量减少。
动物模型是连接基础研究与临床转化的关键桥梁,理想模型应能模拟人类 AD 的核心病理与认知障碍,为机制解析、靶点验证及药效评价提供平台。本文系统探讨 AD 动物模型的构建策略,从模型分类、模型选择策略、模型验证三个方面来展开。
一、AD 模型分类
转基因模型
转基因模型通过遗传操作引入人类 AD 相关突变基因,能模拟 AD 特定病理进程。
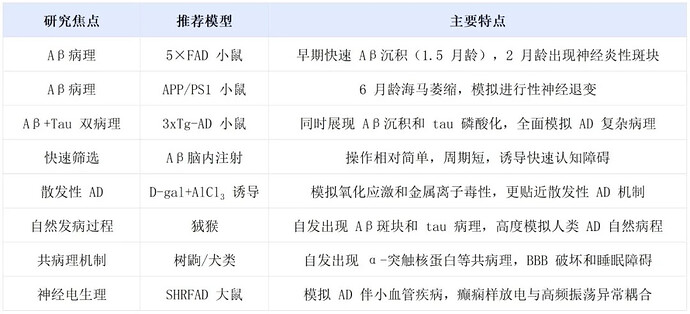
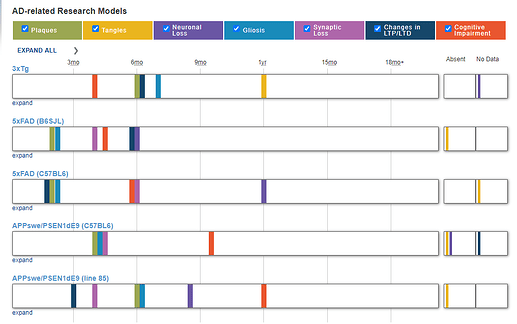
- 5×FAD 转基因小鼠:携带 5 个家族性 AD 基因突变(APP K670N/M671L、I716V、V717I 和 PS1 M146L、L286V),在 1.5 月龄时脑内已有大量 Aβ,2 月龄开始出现神经炎性斑块,能够快速模拟 Aβ 病理。
- 3xTg-AD 小鼠:同时携带 APP、PS1 和 tau 三类基因突变,能同时展现 Aβ 沉积和 tau 磷酸化,更全面模拟 AD 复杂病理。
- APP/PS1 小鼠:广泛使用的双转基因模型,6 月龄开始出现海马萎缩,可以模拟神经退行性病变。
诱导型模型
诱导型模型通过外部干预在野生型动物中引发 AD 样病理特征。
- Aβ 寡聚体脑内注射模型:通过立体定位技术向海马或侧脑室注射 Aβ 寡聚体,诱导快速 Aβ 沉积和认知障碍。
- 化学诱导模型:联合使用 D-半乳糖(D-gal)和氯化铝(AlCl3)处理大鼠,加速认知和行为学障碍,伴随神经元损伤和星形胶质细胞增生。
- 多重诱导模型:脑室注射 Aβ25-35 与 AlCl3,结合丘脑核注射 TGF-β1,更全面模拟 AD 多因素病理。
自然发病模型
自然发病模型是指那些随年龄增长而自发出现 AD 样病理的动物。
- 狨猴:7 岁后可自发出现 Aβ 斑块,tau 蛋白呈现与人类相似的 3R/4R 异构体,存在 α-突触核蛋白异常聚集和睡眠节律紊乱。
- 犬类:老年犬(8-10 岁) 能自然发生认知功能障碍,脑内出现 Aβ 斑块和 tau 病理,症状与人类 AD 高度一致。
- 树鼩:5-6 岁个体可检测 Aβ 聚集和磷酸化 tau,遗传学接近灵长类,适合研究全身性 AD 机制。
二、AD 模型选择策略
选择适合的 AD 动物模型需根据具体研究目标和实验条件,以下是针对不同研究重点的模型选择建议:
三、AD 模型验证
行为学验证
行为学测试是验证动物模型是否成功模拟 AD 核心症状——学习记忆障碍的关键环节。以下是一系列经典的行为学范式及其在 AD 模型动物中的典型表现:
- 水迷宫:评估空间学习与参考记忆的金标准。在训练期,AD 模型鼠(如 APP/PS1)需要花费更长的时间和训练周期才能发现隐藏在水面下的逃生平台。在撤掉平台的空间探索试验中穿过原平台位置的次数和在目标象限停留的时间也显著减少,表明其空间记忆严重受损。
- Y 迷宫:主要检测基于海马功能的短期工作记忆。AD 模型鼠(如 3xTg-AD)在连续探索三个臂时,其自发交替率明显低于对照组,反映了工作记忆与行为灵活性方面的缺陷。
- 新物体识别实验:评估非空间性识别记忆。在熟悉化阶段接触两个相同物体后,AD 模型鼠(如 5×FAD)在测试阶段面对一个新物体和一个旧物体时,探索新物体的偏好指数显著下降,提示其识别记忆能力减退。
- 条件性位置恐惧实验:测试与海马和前额叶皮层相关的情景恐惧记忆。AD 模型鼠在接受足底电击刺激后,当再次放回相同的环境背景中时,其僵直不动的时间显著缩短,这表明其对恐惧相关环境的情景记忆存在障碍。
- 旷场实验:在评估自主探究行为的同时,也间接反映焦虑情绪与运动能力。AD 模型鼠(如 Aβ 注射模型)在旷场中央区域的活动距离和停留时间可能减少,总活动路程也可能下降,体现了其自发活动减少、探究行为减弱或焦虑样行为的增加。
- 高架十字迷宫:专门用于评估焦虑样行为。AD 模型鼠在疾病进程中可能表现出开臂探索时间的减少和进入开臂次数的降低,这反映了其伴随认知衰退可能出现的焦虑样情绪变化。
病理学验证
病理学检测是验证 AD 模型的核心环节。
- Aβ 沉积检测:免疫组织化学染色使用 Aβ 特异性抗体(如 6E10)检测 Aβ 斑块。在 3xTg-AD 小鼠中,海马区神经元胞内 Aβ 免疫阳性面积明显高于野生型小鼠。5×FAD 小鼠在 1.5 月龄时脑内已有大量 Aβ,2 月龄开始出现神经炎性斑块。
- Tau 蛋白磷酸化检测:使用磷酸化 tau 特异性抗体(如 phospho-T231)检测神经原纤维缠结。3xTg-AD 小鼠海马区磷酸化 tau 蛋白免疫阳性面积明显增加。
- 神经元形态分析:高尔基染色显示 D-gal 和 AlCl3 处理 5 周的大鼠额叶和海马中树突分支点数目减少,树突长度变短,棘突密度减少。
- 神经炎症评估:星形胶质细胞(GFAP 染色)和小胶质细胞(Iba-1 染色)检测。D-gal 和 AlCl3 处理 4 周的大鼠海马 CA1、CA3、DG 区星形胶质细胞的标记物 GFAP 的表达显著升高,细胞反应性增生,表明局部神经炎症水平提高。
四、结语
AD 动物模型研究已从单一病理模拟向多因素全身性异常迈进,不同模型各有优劣。转基因模型能模拟特定病理但过度依赖单一基因突变;诱导型模型操作简单但与 AD 慢性进展特点不符;自然发病模型最接近人类疾病但研究周期长、成本高。
未来 AD 动物模型发展有几个重要方向:多物种模型系统开发(如狨猴、犬类、树鼩);技术创新(如 3D 生物材料和脑类器官);以及模型优化(如条件性基因表达系统和多基因编辑技术)。随着技术不断进步,AD 动物模型将更加精准地模拟人类疾病,为攻克这一难题提供更强有力的平台。
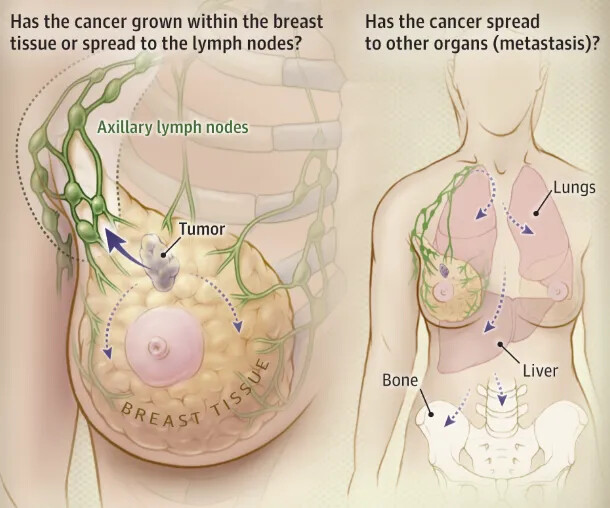
在女性健康的 “威胁清单” 上,乳腺癌一直占据着显著位置,被称为 “粉红杀手”。乳腺癌每年影响全球约 200 万至 250 万女性,据估计,2018 年约有 62.7 万女性死于乳腺癌,在美国,大约八分之一的女性会在一生中患上浸润性乳腺癌。乳腺癌发现的越早越能提高患者的生存机会,并增加可选择的治疗方案。筛查乳腺癌的方法有多种,例如针对乳房的 X 光、超声波、计算机断层扫描和磁共振成像 (MRI)检查。到目前为止,乳腺癌通常的治疗方案包括手术切除,药物治疗和放射治疗。对于已经扩散到身体远处的 IV 期乳腺癌患者,治疗的目标是尽可能长时间地控制乳腺癌。对于 IV 期乳腺癌的治疗方法主要是药物治疗。美国食品和药物管理局(FDA)已经批准了 34 种药物用于治疗乳腺癌,远远超过其他实体肿瘤。但是现有药物的副作用和长期使用产生的耐药性使得寻找乳腺癌治疗的替代技术变得很重要。
对于乳腺癌的基础和转化研究在很大程度上依赖于实验动物模型。肿瘤动物模型可模拟癌症的发生和发展,在发病机制,药物筛选等方面都具有十分重要的作用。本文介绍了不同的乳腺癌实验动物模型,从动物的选择到不同动物模型的建立,并总结了它们的特性、优缺点以及潜在的应用前景。
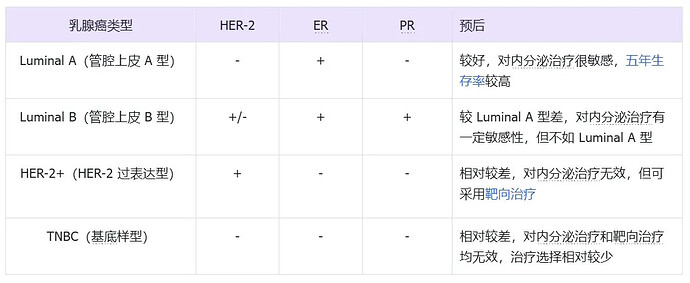
一、乳腺癌分型
乳腺癌是一种异质性疾病,根据分子亚型,乳腺癌可被分为三种类型,分别是 Luminal(最常见的 Luminal A 和 Luminal B),人表皮生长因子受体 2(HER-2)和雌激素(ER)/孕激素受体(PR)受体。在所有已知的乳腺癌亚型中,ER/PR 阳性亚型约占所有报告病例的 70%。近 20% 的乳腺癌缺乏 HER-2、ER 和 PR 的表达,被称为三阴性乳腺癌(TNBC),而 TNBC 具有类似基底样的特征,具有侵袭性表型且转移率会增加。
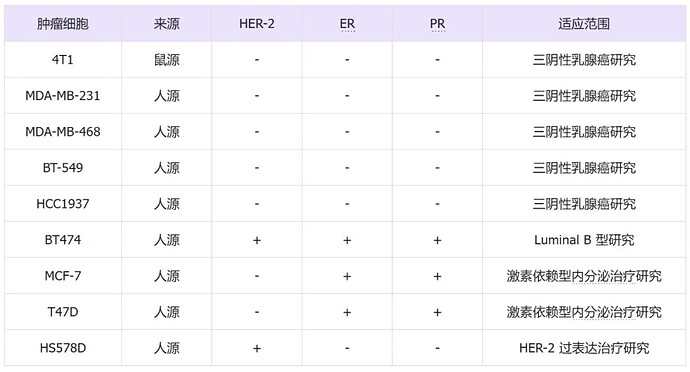
二、乳腺癌细胞
以下所有癌细胞类型在预后、治疗反应、疾病进展和转移器官方面都有所不同,所以人们要对每一种乳腺癌都进行广泛的研究,进而才可以找到潜在的解决方案。
三、乳腺癌动物模型
动物模型不仅可以研究肿瘤发生的生化生理过程,还可以用于肿瘤药物的筛选和基因治疗的探索。随着研究的深入,癌症动物模型的构建方法也越来越多样化,包括自发性肿瘤动物模型,诱发性肿瘤动物模型和移植性肿瘤动物模型等。因此,乳腺癌动物模型亦可分为这三类:
3.1 自发性乳腺癌动物模型
自发性肿瘤动物模型是实验动物种群中不经有意识的人工实验处置而自然发生的一类肿瘤动物模型。乳腺癌自发性肿瘤多采用近交系小鼠,如 C3H,SHN 小鼠。
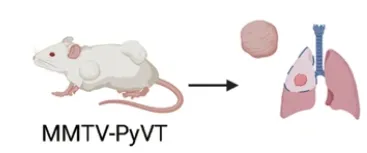
MMTV-PyMT 自发性乳腺癌小鼠(转基因小鼠模型):在 MMTV-PyMT 转基因小鼠中,因 Nr1d1 的缺失将导致肿瘤生长和肺转移增加,多数雌性小鼠在出生后的第 8 周开始发生肿瘤,而雄性小鼠在第 19 周左右产生肿瘤。不同性别 MMTV-PyMT 小鼠自发产生肿瘤后存活时间存在较大差异,雌鼠最长生存时间仅为 12 周,而雄鼠可达 28 周。
模型优点:
-
肿瘤形成接近人类肿瘤发生过程;
-
可用于观察遗传因素在肿瘤发生上的作用和药物的抗肿瘤效果。
模型缺点:
-
由于个体之间肿瘤生长差异较大, 很难在限定时间内获得大量生长均一的荷瘤动物;
-
实验周期相对较长;
-
需要的动物数量多,耗费大,故较少用于抗肿瘤药物的常规筛选。
3.2 诱发性乳腺癌动物模型
诱发性肿瘤动物模型是使用致癌因素在实验条件下诱发动物发生肿瘤的一类肿瘤动物模型,根据诱发位置的不同可分为原位诱发和异位诱发。原位诱发:指将致癌物直接与动物靶组织或靶器官接触而诱发组织或器官发生肿瘤,接触方法可以是涂抹,灌注,喂养或埋置等。异位诱发:获取致癌物接触后的动物组织或器官埋置于该动物或另一正常动物皮下,诱发动物发生的该组织或器官的肿瘤。这些方法具有易观察和取材的优点。
DMBA 诱导乳腺癌动物模型属于原位诱发,即在 SD 大鼠中,将致癌物 80 mg/kg DMBA(二甲基苯蒽)稀释在 0.5 mL 玉米油中,仅单次灌胃大鼠,在 12 周后即可诱发乳腺癌原位肿瘤。
模型优点:
-
模型诱发因素和条件可人为控制,诱发率远高于自然发病率;
-
该法常应用于验证可疑致癌因素的作用以及在肿瘤病因学及肿瘤预防研究。
模型缺点:
-
诱导时间长(3-5 个月,甚至 1-2 年);
-
成瘤率较低,且动物死亡率高;
-
肿瘤出现的时间、部位、病灶数等个体差异较大。
3.3 移植性乳腺癌动物模型
移植性肿瘤动物模型是将临床的肿瘤标本或体外培养的肿瘤细胞移植到动物体内制备成肿瘤疾病动物模型。根据肿瘤细胞与动物品系是否同一来源,又可以分为异源肿瘤动物模型和同源肿瘤动物模型,不同模型所选择的动物也有差异。
同源肿瘤动物模型只需选用与肿瘤细胞同种来源的小鼠品系。而异源肿瘤动物模型(CDX 模型/PDX 模型)必须选用免疫缺陷小鼠如裸鼠或 NXG 小鼠,或经免疫功能抑制处理后的普通小鼠,这些小鼠对异种组织几乎不发生免疫排斥反应,可以接受异种来源肿瘤组织的移植并增殖。
另外,根据移植物类型又可分为细胞移植模型和组织块移植模型,其中,前者是将肿瘤细胞注射到动物特定部位如皮下或原位器官,而后者则是将动物或人体来源的实体肿瘤组织剪成小组织块再进行体内移植。
模型优点:
-
可使一群动物同时接种等量的癌细胞,生长速度比较一致,个体差异较小,接种成活率接近 100%;
-
对宿主的影响相类似,易于客观判断疗效;
-
可在同种或同品系中连续移植,长期保留供试验用;
-
实验周期一般较短,实验条件易于控制。
模型缺点:
-
肿瘤生长速度快,增殖比高,体积倍增时间短,难以完全模拟人体治疗周期;
-
虽模拟恶性肿瘤环境,但难以完全模拟人类肿瘤微环境和复杂病理过程,具有局限性。
四、结语
乳腺癌肿瘤动物模型在乳腺癌研究中应用广泛。在发病机制研究方面,科研人员可以通过观察模型中肿瘤的生长、转移过程,深入了解乳腺癌的发病机制,为寻找新的治疗靶点提供线索。在药物研发领域,动物模型可以用于测试新药的疗效和安全性,评估药物对肿瘤细胞的抑制作用及可能产生的副作用等,从而筛选出有效的治疗药物 。
乳腺癌肿瘤动物模型的构建为乳腺癌研究开辟了新的道路,让我们能够更深入地了解这种疾病,为开发更有效的治疗方法带来希望。随着科技的不断进步,相信未来会有更完善、更精准的动物模型出现,为攻克乳腺癌这一难题贡献更多力量。
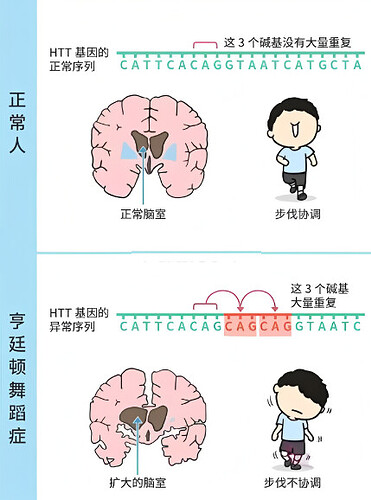
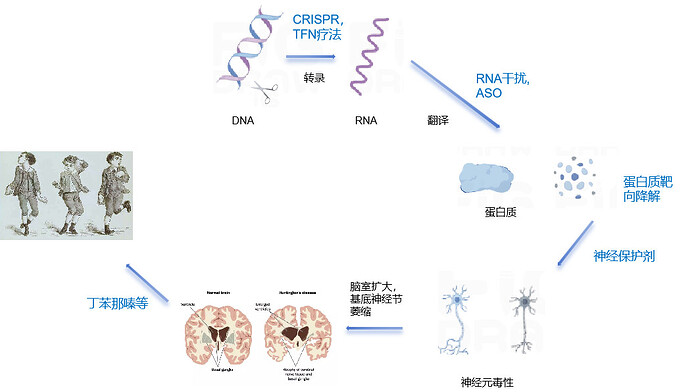
在人类健康的大厦中,罕见病犹如隐藏在角落的暗影,虽不常见,却给患者及其家庭带来沉重的负担。这些疾病种类繁多,症状复杂,往往令人束手无策。而在人体的微观世界里,基因掌控着细胞的生老病死,维系着生命的正常运转。但当基因出现差错,神经细胞的命运便会被改写,从而陷入 “泥沼”—— 亨廷顿舞蹈症(Huntington’s disease, HD)。在众多罕见病中,亨廷顿舞蹈症尤为引人关注,它是一种遗传性神经退行性疾病,患者从肢体不受控制地舞动开始,逐渐丧失运动能力、认知功能,最终走向生命的终点。这一疾病在 1842 年被首次报道,但直到 1872 年,乔治・亨廷顿(George Huntington)提出并解释了这种情况,它才被正式命名为亨廷顿舞蹈症。1993 年,国际亨廷顿病协作研究组克隆出该病的致病基因 IT15,该病致病基因也称为 HTT 基因,为后续的研究和治疗提供了重要基础。
基因突变风暴:亨廷顿舞蹈症的发病机制
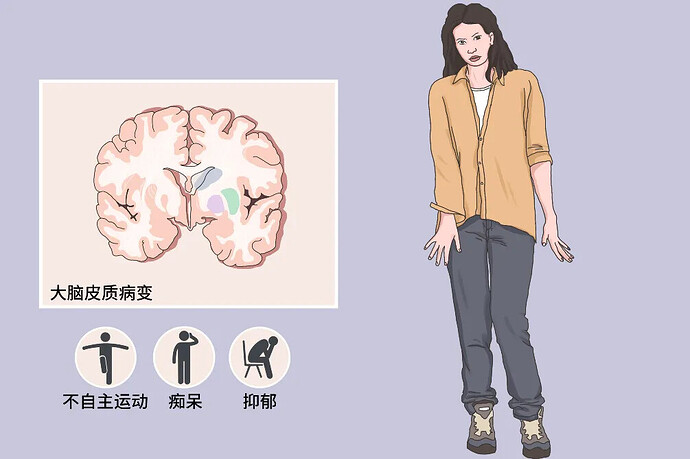
在细胞核内,亨廷顿基因(HTT)发生了 CAG 三核苷酸重复扩增的突变。正常情况下,CAG 重复次数在 20 - 35 次之间,但当重复次数超过 35 次时,HTT 基因编码的亨廷顿蛋白结构和功能发生剧变。异常的亨廷顿蛋白在神经元内聚集,形成包含体,干扰细胞正常的生理功能,如蛋白质降解、细胞信号传导等,最终导致神经元的死亡。这一过程打破了细胞内的 “生态平衡”,原本和谐有序的细胞环境变得混乱不堪,神经元逐渐走向死亡。HD 患者主要病理改变为脑室扩大和基底节区萎缩,其中以尾状核最为明显,壳核和苍白球也有不同程度的萎缩。神经元缺失主要见于基底节区,其中尾状核和壳核的神经元功能障碍与舞蹈样动作有关,皮质神经元缺失可能与痴呆有关。
神经细胞的危机:亨廷顿舞蹈症的临床表现
1.运动功能的 “乱舞” :亨廷顿舞蹈症最直观的表现是不自主的舞蹈样动作。患者的手脚仿佛被一股无形的力量驱使,不停地抽动、扭动,难以控制。这些动作在早期可能只是轻微的不协调,但随着病情发展,会逐渐加重,影响患者的行走、穿衣、进食等日常活动。患者在尝试完成精细动作时,如系扣子、写字等,会显得笨拙而吃力,仿佛在跳一场 “失控” 的舞蹈。
2. 认知与精神的 “迷雾” :除了运动功能受损,患者的认知功能也会逐渐减退,表现为记忆力下降,学习新知识的能力减弱,注意力难以集中,思维变得迟缓。患者还可能出现抑郁、焦虑、易激惹等情绪障碍,毫无征兆地陷入无端的悲伤或焦虑之中,对周围的事物失去兴趣,甚至产生自杀的念头。
治疗的曙光:亨廷顿舞蹈症的治疗进展
尽管亨廷顿舞蹈症目前尚无根治之法,但科学家们并未放弃,正在积极寻找治疗策略。
- 药物治疗的 “缓兵之计” :目前的药物治疗主要以缓解症状为主。抗精神病药物如利培酮、奥氮平等,可用于控制患者的精神症状;抗抑郁药物如氟西汀、帕罗西汀等,能缓解抑郁情绪;抗焦虑药物如地西泮等,可减轻焦虑症状。此外,氘代丁苯那嗪(Austedo)可用于治疗舞蹈症状。
- 基因治疗的 “精准打击” :基因治疗是目前研究的热点之一。通过使用病毒载体将正常的 HTT 基因导入患者体内,以替代异常的基因,从而减少 HTT 蛋白的异常聚集。这种方法如同对基因 “叛徒” 进行 “精准打击”,有望从根本上改变疾病的进程。一些临床试验已经显示出一定的疗效,但仍需要进一步的研究和验证。
- 细胞治疗的 “新生力量” :细胞治疗是另一种潜在的治疗方法。通过移植干细胞或诱导多能干细胞(iPS 细胞)来替代受损的神经元。这种方法如同为患者的大脑注入 “新生力量”,在动物模型中已经取得了一定的成功,但在人类患者中的应用仍处于早期阶段。
4.生活方式干预的 “辅助助力” :除了药物治疗和基因治疗外,生活方式干预也可以对患者产生积极影响。适当的运动、营养均衡的饮食、心理支持等都可以帮助患者改善症状,提高生活质量。这些生活方式的调整如同 “辅助助力”,虽不能直接治愈疾病,但能为患者提供更好的身体和心理状态,增强其应对疾病的能力。
结语
虽然目前 HTT 基因导致的 “风暴” 仍占据上风,但科学家们正在不断努力,寻找反击的策略。从药物治疗的 “缓兵之计”,到基因治疗的 “精准打击”,再到细胞治疗的 “新生力量” 和生活方式干预的 “辅助助力”,我们看到了越来越多的希望,相信有一天能够从根本上解决亨廷顿舞蹈症。
阿尔茨海默病(Alzheimer’s Disease, AD)是一种常见的神经退行性疾病,主要发生在老年或老年前期,因此又被称为老年痴呆。主要症状包括:记忆障碍,尤其是近期记忆的丧失;语言和沟通能力下降;视觉空间技能受损,导致导航困难;思考和判断能力减退;人格和行为变化,如情绪波动和社交退缩。随着病情进展,患者还可能遇到日常生活技能的减退、时间感和空间感障碍、执行功能障碍,以及睡眠和运动失调等问题。这些症状会一步步加重,严重影响患者的生活质量。
通俗地讲,一切 AD 病情的发展都由遗忘开始,它悄悄偷走人们宝贵的记忆和认知能力,使得患者忘记如何坐公交、如何刷牙、如何吃饭、如何睡觉、如何走路,直至完全失去自理能力,陷入如婴儿般的混沌状态。
自从 1907 年 Alois Alzheimer 首次描述这种疾病以来,科学家们就像侦探一样,一直在寻找阿尔兹海默症的致病线索。阿尔茨海默症的发病机制可能涉及多个方面,包括 β-淀粉样蛋白(Aβ)的异常积累形成老年斑、Tau 蛋白的异常磷酸化导致神经纤维缠结、氧化应激和神经炎症对神经元功能的影响、神经元衰老导致的神经退行性变化[1]以及与胰岛素抵抗和糖尿病相关的代谢紊乱[2]。这些因素相互作用,共同推动了阿尔茨海默症的发展。
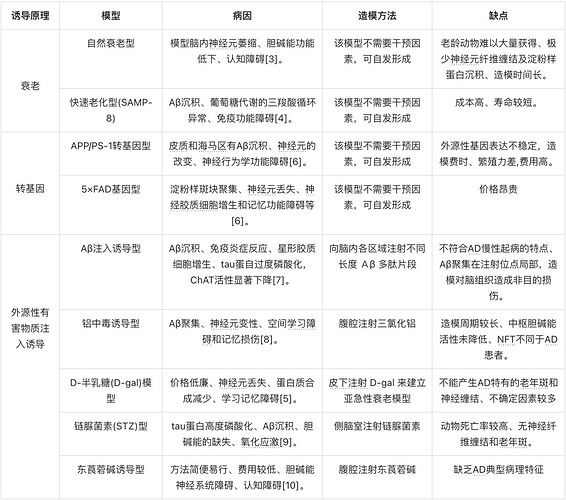
为了更深入探究 AD 的具体发病机制和针对性的治疗,科学家们下了很多功夫,他们开发了多种 AD 动物模型,目前常用的 AD 动物模型的建模方法主要包括衰老模型、转基因模型、外源性有害物质注入模型等(查看下表)。
在探索阿尔茨海默症这一复杂疾病的道路上,我们正逐步揭开其成因和发病机制的层层迷雾。虽然我们还未完全掌握其全部秘密,但医学的每一次进步都为我们带来了新的希望。医学的进步已经为我们提供了包括乙酰胆碱酯酶抑制剂和 Lecanemab 在内的新疗法。这些药物不仅能够改善患者的认知和记忆功能,Lecanemab 更是在 2023 年为阿尔茨海默症治疗领域带来了新的进展,使广大患者及家属不仅看到了科学的力量,更感受到了希望的温暖。让我们用爱和关怀为阿尔茨海默症患者点燃一盏灯,照亮他们回家的路。愿我们的陪伴和支持,成为他们记忆中不灭的星光,温暖他们每一个被遗忘的角落。
社会的快速发展直接影响了人们的工作生活方式,糖尿病的发病率也随之在全球范围内持续攀升,成为了亟待公众深入了解与积极应对的重大公共卫生问题。
糖尿病发病类型:
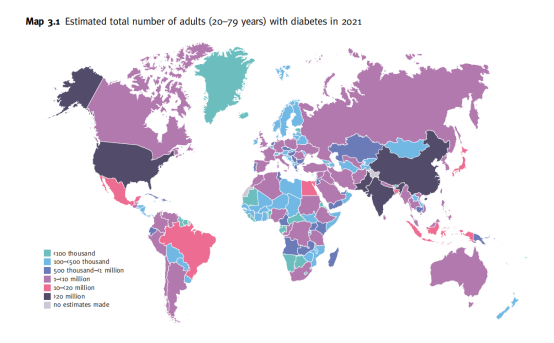
国际糖尿病联盟(IDF)发布的《糖尿病地图集》数据显示,2021 年全球约有 5.37 亿成年人(20-79岁)患有糖尿病,总体患病率约为 10.5%,即每 10 个人中就有 1 个糖尿病患者。预计到 2045 年,这一数字将激增至 7.83 亿。
其中,中国的糖尿病患者人数位居全球之首,约有 1.4 亿人受到疾病影响,超过全球糖尿病患者总数的四分之一。
糖尿病主要分为以下几种类型,各类型的占比因地区、年龄、遗传和生活方式等因素而有所差异:
1 型糖尿病(T1D):
特点: 以前被称为“幼年型糖尿病”或“胰岛素依赖性糖尿病”,患者的胰岛 B 细胞受到破坏,导致胰岛素绝对缺乏。
占比: 在全球及中国的糖尿病患者中,1 型糖尿病患者占比较小。在我国,1 型糖尿病患者占比约为 5%。
2 型糖尿病(T2D):
特点: 由于胰岛素抵抗或胰岛素分泌不足所导致。患者体内的胰岛素可能并不缺乏,但胰岛素的作用大打折扣,无法有效地将血糖转化为能量。
占比: 2型糖尿病是糖尿病患者中的绝大多数。在我国,2 型糖尿病患者占比超过 90%。
妊娠期糖尿病 :
特点: 在怀孕时出现的糖尿病,或是在怀孕时出现的糖耐量下降的症状,但不包含怀孕之前确诊的糖尿病。
占比: 妊娠期糖尿病的占比因孕妇群体的特殊性而有所变化,但也是一个不容忽视的群体。
糖尿病的发病机制:
别看它名字里带着个“糖”字,糖尿病可不仅仅是“糖吃多了”那么简单。它更像是一场身体内部的“甜蜜陷阱”,考验着我们的智慧、毅力。在这场没有硝烟的战争中,每个人都是自己守护者,而了解这位“不速之客”的真实面目,掌握与之和平共处的技巧,就成了我们共同的课题。
糖尿病的发病机制复杂,不同类型的糖尿病有不同的发病机制。
1 型糖尿病(T1D):
1 型糖尿病主要是一种自身免疫性疾病。患者携带某些易感基因,在环境因素(如病毒感染)的触发下,自身免疫反应被激活,导致胰岛 B 细胞受到破坏,胰岛素分泌绝对减少,从而引发糖尿病。遗传因素和环境因素共同作用,导致 1 型糖尿病的发病。
2 型糖尿病(T2D):
2 型糖尿病是由遗传和环境因素共同参与的一种多基因遗传疾病,是严重威胁人类健康的重要非传染性慢性疾病之一,但是其发病机制尚不清楚。
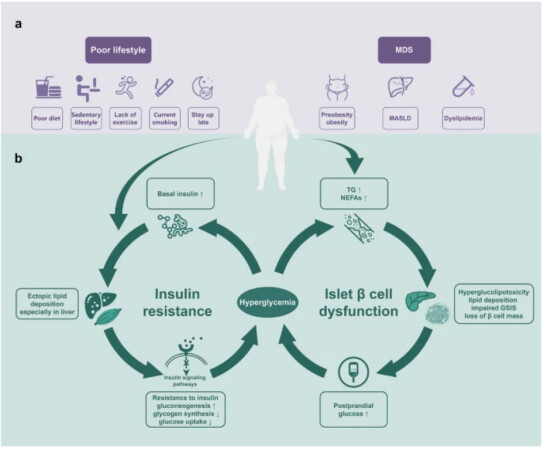
四川大学华西医院糖尿病与代谢研究中心内分泌代谢科的童南伟教授团队在《Nature》上阐述了 2 型糖尿病的发病机制, 胰岛素抵抗(IR)和 β 细胞功能障碍是两个核心的病理生理机制。
2 型糖尿病患者摄入的热量过多,同时缺乏运动,导致肥胖。肥胖会引起机体过多的脂质沉积在非脂肪组织中,阻断胰岛素信号通路,进而导致胰岛素抵抗,特别是在肝脏中,增加肝脏的葡萄糖产生,削弱葡萄糖的摄取,从而增加血糖和基础胰岛素水平,而胰岛素升高促进脂质沉积,进一步加重胰岛素抵抗,形成恶性循环;葡萄糖和脂质升高对胰岛 β 细胞产生高糖脂毒性,脂质在胰岛中沉积,破坏胰腺 β 细胞的分泌功能和数量,进一步增加血糖。
炎症、异位脂质沉积、内质网应激 (ERS) 和氧化应激也会通过损害胰岛素敏感性和 β 细胞功能障碍参与 T2D 的发生和进展,与代谢紊乱相互影响。
妊娠期糖尿病 :
妊娠期糖尿病的发病机制与妊娠的特殊阶段有关。在怀孕期间,孕妇体内的激素水平会发生变化,同时对于胰岛素的反应也可能出现异常,导致血糖升高。
糖尿病的病理生理:
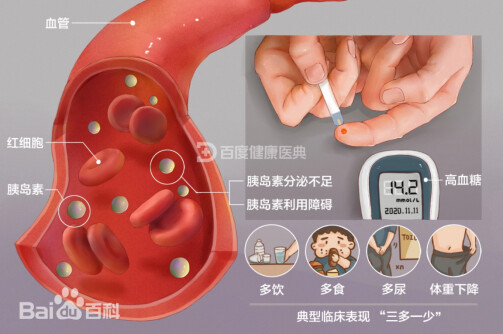
糖尿病的病理生理主要涉及糖、脂肪、蛋白质的代谢紊乱,以及由此引发的一系列并发症。糖尿病的症状可以因人而异,其表现取决于血糖升高的程度和持续时间,以及个体对高血糖的反应,主要的临床症状表现为“三多一少”,传统称为消渴症:
多尿: 由于体内胰岛素不足或作用受损,身体无法有效利用葡萄糖,导致血糖水平升高。为了维持血糖平衡,身体会增加尿液中葡萄糖的排出,同时也带走了大量水分,从而引发多尿。
多饮: 由于多尿导致体内水分流失,患者常感到口渴,经常摄入水分。
多食: 由于身体无法有效利用葡萄糖,即使患者摄入大量食物,仍可能感到饥饿。
体重下降: 尽管患者食欲增加,但由于身体无法利用葡萄糖来产生能量,而是开始分解脂肪和肌肉,导致体重下降。
糖尿病动物模型:
在探讨糖尿病的病理生理机制时,我们了解到其核心问题在于胰岛素的分泌绝对或相对缺乏,导致血糖升高,进而引发一系列临床综合征。这种病理生理变化不仅涉及胰岛素抵抗,还包括胰岛 β 细胞功能受损、胰高糖素分泌增加等多重因素。
为了深入研究糖尿病及其治疗方法,科学家们建立了多种糖尿病动物模型。这些模型通过模拟人类的糖尿病病理生理过程,为药物研发、疗效评估及安全性评价提供了强有力的工具。
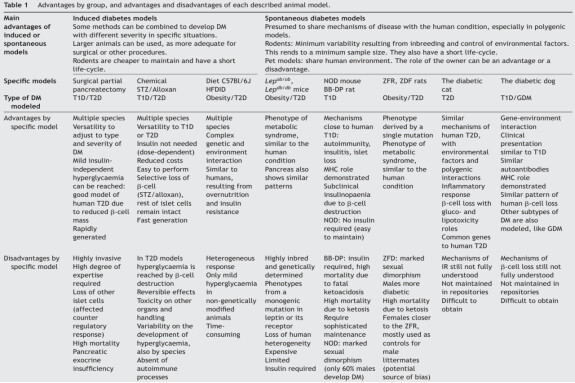
Yeray Brito-Casillas 对常见的糖尿病动物模型进行了一个综述,其中除了自发性糖尿病模型(如 NOD 小鼠、BB 大鼠等)、化学诱导糖尿病模型(使用链脲佐菌素或四氧嘧啶等药物诱导)以及基因修饰糖尿病模型(通过基因编辑技术构建特定基因型的糖尿病动物),还包括了新的有价值的模型,例如患有自发性糖尿病的狗和猫。接下来为大家介绍几种现目前常用的糖尿病动物模型。
自发性糖尿病模型:
1 型糖尿病(T1D):
NOD 小鼠是一种自身免疫性1型糖尿病的多基因模型,可自发形成非肥胖胰岛素依赖性的糖尿病(Insulindependent Diabetes Mellitus,IDDM)。
这种疾病是由于胰岛 β 细胞抗原被错误的提呈给辅助性 T 细胞,使机体大量产生针对胰岛 β 细胞的特异性抗体,破坏了胰岛细胞功能,大大降低胰岛素的合成与分泌,促使机体产生糖尿病。
NOD 小鼠具有明显的性别二态性,雌性小鼠约 12 周龄即可观测到胰岛素含量的显著降低(10%),IDDM 症状较雄鼠发作更早,发病率更高 30 周龄雌性发病率 90-100%,雄性 40-60%) ,使用更广泛。
2 型糖尿病(T2D):
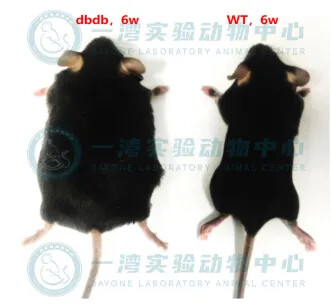
Lep(ob/ob) , Lep(db/db) 两种小鼠它们分别代表了瘦素(Leptin)基因和瘦素受体(Leptin Receptor)基因的纯合突变。瘦素是由脂肪细胞分泌的蛋白质类激素,对调节能量平衡和摄食行为起重要作用。
由于 ob 基因突变,Lep(ob/ob) 小鼠会出现食欲大增、体重剧增等严重的肥胖特征。这些小鼠在 2 周龄时肥胖个体外表上就有别于正常个体,在 8~9 月龄时体重增加到约为 70 克,并伴随多种代谢失调,包括脂肪形成增加、脂肪分解减少等。此外,它们还会出现高血糖和胰岛素抵抗等症状。
而 Lep(db/db) 在 4 周龄时出现明显的高血糖,血糖浓度继续上升,峰值在 3~5 个月。期间伴随代谢异常包括高脂血症、严重肥胖、多食、易渴、多尿、体温调节紊乱和活动能力下降。Lep(db/db) 小鼠还会出现胰岛 β 细胞严重受损、糖尿病肾病等并发症,且寿命相对较短。
化学诱导糖尿病模型:
对胰岛 β 细胞具有亲和力的药物和毒物常被用于开发 DM 模型,目前最常用的药物还是链脲佐菌素链(Streptozocin, STZ),STZ 是一种具有亚硝基脲结构的药物,它能够选择性地损伤胰岛 β 细胞。
这种损伤作用具有剂量依赖性,即注射剂量的大小决定了胰岛 β 细胞损伤的程度。正如我们前文提到的胰岛 β 细胞是负责分泌胰岛素的细胞,胰岛素是调节血糖水平的关键激素。当胰岛 β 细胞受到损伤时,其分泌胰岛素的能力会下降或丧失,导致血糖水平持续升高,从而引发糖尿病。
以不同的剂量、间隔或途径给药(即腹腔与静脉),STZ 都可能模拟 T1D、T2D、DM 前期或其他情况的疾病。
Furman BL 对使用 STZ 的糖尿病造模进行了详细的实验说明,单次大剂量(即小鼠 200 mg/kg)STZ 通过直接毒性作用导致暴发性糖尿病,但严重程度取决于给药途径和动物易感性。同时,相同的药物以多次小剂量(即小鼠 40 mg/kg)给药数天( 1—5 次),也可以引起类似于人类 T1D 的过程,伴有免疫结构和胰岛素减少。
而进行 T2D 造模过程需在药物注射前先对小鼠进行高脂饲料的喂养,诱发小鼠的胰岛素抵抗,然后以多次小剂量给药,它就只会破坏一部分胰岛 β 细胞的功能,而不是全部,这种部分损伤导致外周组织对胰岛素的敏感性降低,加上高脂饲料喂养诱发的胰岛素抵抗两者结合便可诱导出病理、生理改变都接近于人类 T2D 的动物模型。
糖尿病动物模型的建立为研究其病理机制及药物开发提供了重要工具,推动了糖尿病治疗的科研进展。
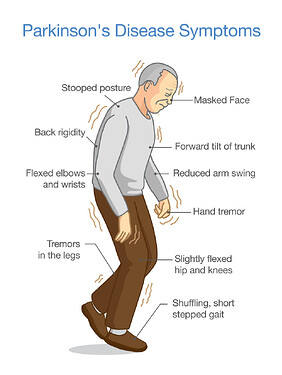
帕金森氏病(Parkinson’s Disease,PD)是一种会影响运动的神经退行性疾病,常见于老年人,在60岁左右该疾病的临床表现逐渐显现,具体涵盖:静止性震颤,其形态常被被比喻为“搓丸样”动作;肌强直,展现出“铅管样”或“齿轮样”的显著僵硬特性;运动迟缓,宛如时间被刻意放缓的“慢动作回放”;以及姿势与平衡障碍,其外在表现颇似“醉酒步态”。更为复杂的是,帕金森氏病患者还可能面临感觉系统受损及认知功能减退等一系列非运动相关的症状挑战。
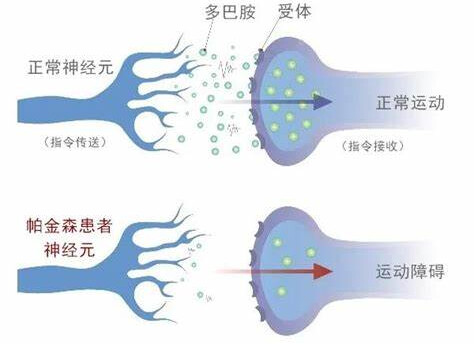
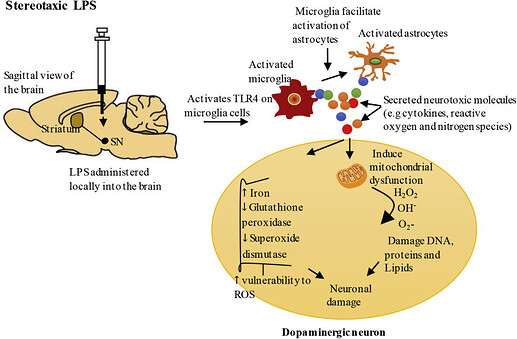
其主要病理变化是黑质致密部(Substantia Nigra Pars Compacta, SNc)中多巴胺(Dopamine, DA)能神经元进行性丢失,并伴有纹状体多巴胺水平的下降,α-突触核蛋白(α-synuclein, α-Syn)为主要成分的路易小体(Lewy Body )的形成,通过多巴胺和乙酰胆碱(Acetylcholine, ACh)两种递质控制兴奋和抑制性信号的输出而调控基底神经节环路下游的运动和认知等活动[1],致使大脑中控制运动的基底节环路损伤,降低了对运动皮层的控制,大大阻碍了患者的活动能力。导致这一病理变化的确切因素尚不清楚,遗传因素、环境因素、年龄老化、氧化应激等均可能参与 DA 能神经元的变性死亡过程。PD 的发病机制和各作用靶点之间的联系仍是现今研究的热点,因此在基础研究中实验动物模型的制备对 PD 的研究具有举足轻重的作用。
为了深入研究帕金森病的发病机制和治疗方法,科学家们可是没少下功夫,他们开发了多种 PD 动物模型。其中,6-羟基多巴胺(6-hydroxydopamine,6-OHDA)模型、1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)模型、百草枯(Paraquat)模型、利血平模型、鱼藤酮模型、脂多糖模型和转基因小鼠模型等较为常用。下面我们一起来了解几种常见的 PD 动物模型的建立方法吧。
6-OHDA模型:
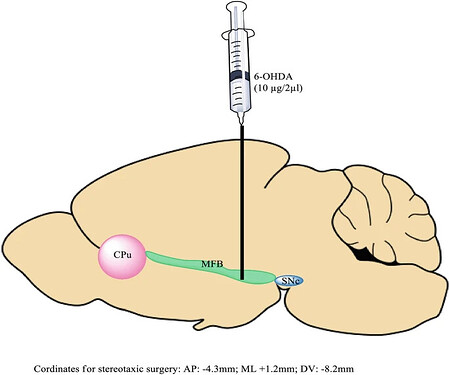
6-OHDA 是多巴胺的羟基化衍生物,因其化学结构与 DA 类似,因此能够同 DA 竞争摄取位点,进而被摄入细胞内。进入胞内后,6-OHDA 能够被氧化分解,产生活性氧,通过单胺氧化酶进一步产生氧自由基,或直接引起线粒体功能障碍,导致 DA 能神经元死亡。因其造成动物的生物化学和神经化学损伤类似于 PD,故常被用于诱导 PD 动物模型。由于 6-OHDA 不能穿透血脑屏障,因此为了达到中枢神经系统毁伤的效果,需要在小鼠脑内注射 6-OHDA,具体的注射位点可以是 DA 能神经元胞体富集的黑质致密部SNc,或者是神经通路下游末梢丰富的纹状体(尾壳核,CPu)或内侧前脑束(Medial Forebrain Bundle, MFB),然后通过轴突运输回胞体,从而达到损伤 DA 神经元的目的[2]。
MPTP模型:
MPTP 本身没有神经毒性,具有毒性作用的是它的代谢物。MPTP 能够穿过血脑屏障,作用于神经胶质细胞,产生甲基苯基吡啶离子 MPP+。MPP+ 能够抑制线粒体呼吸功能,产生氧自由基,从而损伤DA能神经元,降低纹状体中的 DA 水平,进而导致 PD 症状。通过腹腔注射 MPTP,破坏小鼠黑质多巴胺神经元,可以导致帕金森病样症状的出现[3]。这种方法操作简单,成功率高,最常用的 PD 动物模型之一。
百草枯模型:
百草枯在分子结构和生物化学方面与 MPTP 的活性代谢物1-甲基-4-苯基吡啶(MPP(+))相似,MPTP 是一种神经毒素,可以在动物模型和人类中诱导 PD 样特征[4]。常通过腹腔注射、脑内注射或皮下注射百草枯建立小鼠、大鼠 PD 模型。百草枯模型可模拟 PD 病理和行为学方面的部分改变,在研究环境因素与 PD 发病机制的关系中有一定价值。
利血平模型:
当啮齿类动物注射利血平后,由于囊内摄取的多巴胺、5-羟色胺和去甲肾上腺被封闭,在胞质内被降解,快速降低单胺水平,导致肌肉僵硬等 PD 的症状[5]。该模型制作方法简单,雄性 Wistar 大鼠腹腔注射一定剂量的利血平后即可使其出现骨骼肌僵硬、震颤、姿势异常等类似 PD 的症状。该模型迅速易得,一定程度上模拟了 PD 的临床表现和神经化学改变。
鱼藤酮 模型:
鱼藤酮能够均匀地作用于整个大脑中的复合体I,进而引发黑质多巴胺能系统出现高度特异性的神经退行性病变[6]。复合体I在系统中的部分功能缺陷,已足以模拟并再现帕金森病在行为学、解剖学、神经化学以及神经病理学上的典型特征。给药途径有立体定位脑内给药、静脉给药、腹腔注射给药、经皮给药、灌胃和皮肤接触给药等。鱼藤酮动物模型更符合 PD 病理进程,黑质-纹状体通路及肠道神经元均出现路易小体,其明显的劣势为动物病死率过高。
脂多糖(LPS)模型:
LPS 是一种强有力的炎症刺激物,可明显激活黑质小胶质细胞,随后导致 DA 能神经元大量死亡[7]。通过多种方式给予动物:黑质内注射、苍白球注射、纹状体注射和腹腔注射。LPS 模型是 PD 模型的理想模型,但是造模周期较长,需4到12个月。
转基因模型:
在 PD 的转基因动物模型中,SNCA 转基因模型被最广泛使用。SNCA 是第一个被发现与家族性 PD 相关的基因,编码 α-syn。全基因组关联分析表明 SNCA 与 PD 发病密切相关,SNCA 基因高表达是 PD 的一个重要病理学标志[8]。
借助这些动物模型,多年来,科学家们得以深入研究帕金森病的发病机制和开发帕金森病的治疗方法,并取得了许多重要成果[8]。
参考文献:
-
Goedert M, Spillantini MG, Del Tredici K, Braak H (2013) 100 years of Lewy pathology. Nat Rev Neurol 9, 13–24.
-
Kumari N, Luthra PM. Establishment of a 6-OHDA Induced Unilaterally Lesioned Male Wistar Rat Model of Parkinson’s Disease. Methods Mol Biol . 2024;2761:491-498.
-
Santoro M, Fadda P, Klephan KJ, Hull C, Teismann P, Platt B, Riedel G. Neurochemical, histological, and behavioral profiling of the acute, sub-acute, and chronic MPTP mouse model of Parkinson’s disease. J Neurochem. 2023 Jan;164(2):121-142.
-
See WZC, Naidu R, Tang KS. Cellular and Molecular Events Leading to Paraquat-Induced Apoptosis: Mechanistic Insights into Parkinson’s Disease Pathophysiology. Mol Neurobiol . 2022;59(6):3353-3369.
-
Jiang C,Wan X,Jankovic J,et al. Dopaminergic properties and ex-perimental anti-parkinsonian effects of IPX750 in rodent models ofParkinson disease[J]. Clin Neuropharmacol,2004,27( 2) : 63-73.
-
Ikram H, Haleem DJ. Repeated treatment with a low dose of reserpine as a progressive model of Parkinson’s dementia. Pak J Pharm Sci. 2019 Mar;32(2):555-562.
什么是肿瘤罕见病?
肿瘤罕见病是指那些发病率低、患病人数少的某些肿瘤。根据世界卫生组织 (WHO) 的定义,肿瘤罕见病的患病率低于 0.65% 至 1%,约占人类疾病的 10%。虽然每种罕见肿瘤的发病率小,但全球范围内它的总患病人数却不容小觑。这些肿瘤较为罕见,诊断和治疗往往面临更大的挑战,包括误诊率高、治疗方案有限等问题。
常见的肿瘤罕见病有哪些?
01. 心脏肿瘤
什么是心脏肿瘤?
心脏肿瘤分为原发性和继发性。原发性心脏肿瘤极为罕见,每 10 万人中仅有 0.1-0.3 人发病 ,其中又以良性肿瘤居多,最常见的是黏液瘤,约占所有原发性心脏肿瘤的 50%[1]。黏液瘤通常呈息肉状或绒毛状,多生长在左心房,就像一颗不受欢迎的 “赘生物”,随着心脏的跳动而摆动。
而继发性心脏肿瘤则是由身体其他部位的原发恶性肿瘤转移而来,常见的原发肿瘤包括肺癌、乳腺癌、黑色素瘤等。相较于原发性心脏肿瘤,继发性心脏肿瘤的发病率相对较高,且病情往往更为凶险。
如何诊断心脏肿瘤?
由于心脏肿瘤的症状不特异,诊断起来颇具难度。超声心动图是诊断心脏肿瘤的首选方法,它就像给心脏做了一次 “超声透视”,可以清晰地显示心脏内部肿瘤的位置、大小、形态以及与周围组织的关系。
心脏磁共振成像 (MRI) 也是重要的诊断工具,它能提供更详细的心脏结构和组织信息,帮助医生进一步判断肿瘤是良性还是恶性。此外,对于一些高度怀疑心脏肿瘤但又难以确诊的患者,还可以进行心内膜心肌活检,通过获取心脏组织进行病理检查,以明确肿瘤的类型和性质。
治疗策略
手术切除:
手术切除是治疗心脏肿瘤的主要方法,尤其是对于良性肿瘤,如黏液瘤,通过手术完整切除肿瘤,患者往往可以彻底恢复。
靶向治疗和免疫治疗:
靶向药物可以精准地作用于靶点肿瘤细胞,抑制肿瘤的生长。免疫治疗则是通过激活患者自身的免疫系统,增强免疫细胞对肿瘤细胞的识别,从而杀死肿瘤细胞。
放疗和化疗:
化疗和放疗常常是综合治疗的一部分。化疗药物可以通过血液循环到达全身,抑制肿瘤细胞的生长和扩散。放疗则是利用高能射线对肿瘤进行局部照射,杀死肿瘤细胞。
02. 神经内分泌肿瘤 (NET)
什么是NET?
神经内分泌肿瘤 (Neuroendocrine Tumors, NET) 起源于神经内分泌细胞,后者广泛分布于全身各处,从胃肠道、胰腺到肺、甲状腺等器官都有它们的身影。这就导致神经内分泌肿瘤可以发生在身体的多个部位,具有高度的异质性。简单来说,它是一种既具有神经内分泌细胞特征,又能产生和分泌多种生物活性物质的肿瘤[2]。在中国,基于人群的癌症监测点数据显示,NET的发病率已达每 10 万人约 4.1 例[3] 。
如何诊断NET?
医生首先需要详细询问患者的病史和症状表现,结合全面的体格检查,初步判断是否存在神经内分泌肿瘤的可能。从医学检测看,血液检查是重要的诊断手段之一,通过检测血液中的肿瘤标志物,如嗜铬粒蛋白 A(CgA)、神经元特异性烯醇化酶 (NSE) 等,可以辅助诊断。此外,也可通过 CT、MRI 检测,清晰地显示肿瘤的位置、大小和形态,帮助医生判断肿瘤的侵犯范围。
治疗策略:
手术切除:
手术切除是首选的治疗方法,也是唯一有可能根治的手段。手术方式根据肿瘤的部位、大小和分期而定。
药物治疗:
生长抑素类似物(如奥曲肽)可以控制症状并抑制肿瘤生长。靶向药物如依维莫司 (Everolimus) 和舒尼替尼 (Sunitinib) 也用于治疗晚期NET。
放射性核素治疗:
对于无法手术的NET,放射性核素治疗(如Lu-177 DOTATATE)是一种有效的选择。
03. 软组织肉瘤
什么是软组织肉瘤?
软组织肉瘤是间叶组织来源的恶性肿瘤,可以简单认为是四肢肌肉骨骼的恶性肿瘤。软组织肉瘤极为罕见,在全球范围内,每10万人中就有约2.9-5人患病。软组织肉瘤有70多种病理亚型,最常见亚型包括未分化多形性肉瘤、脂肪肉瘤、平滑肌肉瘤、滑膜肉瘤、横纹肌肉瘤等,种类繁多、异质性大、治疗方式不一,诊断和治疗难度大。
如何诊断软组织肉瘤?
医生首先会详细询问以及进行体格检查,从而进行初步的诊断排查,后可通过影像学检查,如 MRI(核磁共振成像),CT(计算机断层扫描)和 PET - CT(正电子发射断层显像与计算机断层显像融合技术),通过这些检查,可初步判断肿块的位置、大小和性质,更清楚的显示深部软组织肉瘤。最后,通常采用粗针穿刺活检的方法,获取肿瘤组织进行病理分析,更加明确肿瘤的类型、分化程度和恶性程度。
治疗策略:
手术切除:
手术切除是软组织肉瘤的主要治疗方法,也是实现根治的关键。手术的原则是在保证彻底切除肿瘤的前提下,尽可能保留肢体功能和重要脏器功能[4]。
放 疗:
术前或术后放疗可以降低局部复发的风险。
化疗 :
对于高风险或转移性肉瘤,化疗是重要的治疗手段。常用的化疗药物包括阿霉素 (Doxorubicin) 和异环磷酰胺 (Ifosfamide)。
04 . 肾上腺皮质癌 (ACC)
概述
肾上腺皮质癌 (Adrenocortical Carcinoma, ACC) 肾上腺皮质癌,是一种起源于肾上腺皮质细胞的恶性肿瘤。当肾上腺皮质细胞发生恶变,不受控制地异常增殖时,便形成了肾上腺皮质癌。肿瘤的生长不仅会破坏肾上腺的正常结构,还会干扰激素的正常分泌,进而引发一系列严重的健康问题。肾上腺皮质癌的发病率极低,全球发病率约为每 10 万人中 0.1-0.2 例,但恶性程度高[6]。
如何诊断 ACC
血液检查:
检测血液中多种激素水平,若激素水平异常升高,且失去正常的昼夜节律,往往提示肾上腺皮质功能异常。
尿液检查:
24 小时尿游离皮质醇、尿醛固酮等指标的检测也有助于诊断。
影像学检查:
超声检查初步观察肿瘤的大小、形态、边界等情况;CT 和 MRI 能清晰显示肿瘤的位置、大小、密度以及与周围组织器官的关系,帮助医生判断肿瘤侵犯范围和有无转移;PET - CT 则从代谢水平评估肿瘤活性,对于发现早期转移灶灵敏度高。最终确诊仍需要依靠病理检查。通常在超声或 CT 引导下进行细针穿刺活检,获取肿瘤组织进行病理分析,观察肿瘤细胞的形态、结构以及免疫组化特征,明确肿瘤类型、分化程度和恶性程度。
治疗策略:
手术切除:
手术切除是肾上腺皮质癌最重要的治疗方法,也是唯一有可能根治的手段。手术方式包括开放性手术和腹腔镜手术,医生会根据肿瘤大小、位置、与周围组织关系以及患者身体状况等因素,选择合适的手术方式。
放疗 :
放疗主要用于术后辅助治疗,降低局部复发风险;对于无法手术切除的患者,放疗可作为姑息治疗手段,缓解肿瘤压迫引起的疼痛等症状。
化疗 :
化疗在肾上腺皮质癌治疗中作用重要,尤其适用于无法手术切除、术后复发或发生转移的患者。常用化疗药物有米托坦、顺铂、依托泊苷等。
靶向治疗与免疫治疗 :
靶向治疗药物精准作用于肿瘤细胞特定靶点,抑制肿瘤细胞生长扩散。例如,针对肿瘤血管生成、细胞信号传导通路的靶向药物,正处于临床试验探索疗效阶段。免疫治疗则激活患者自身免疫系统,增强免疫细胞对肿瘤细胞的识别和攻击能力。
参考文献:
-
Joseph J, Maleszewski,Melanie C, Bois,John P, Bois et al. Neoplasia and the Heart: Pathological Review of Effects With Clinical and Radiological Correlation.[J] .J Am Coll Cardiol, 2018, 72: 0.
-
Stefano, La Rosa,Challenges in High-grade Neuroendocrine Neoplasms and Mixed Neuroendocrine/Non-neuroendocrine Neoplasms.[J] .Endocr Pathol, 2021, 32: 0.
-
Shen, Chan, et al. “Racial differences in the incidence and survival of patients with neuroendocrine tumors.” Pancreas 48.10 (2019): 1373-1379.
-
Gonzalez Marcos R,Mendez-Guerra Carolina,Goh Megan H et al. Principles of Surgical Treatment of Soft Tissue Sarcomas.[J] .Cancers (Basel), 2025, 17: undefined.
-
Abramson Jeremy S,Diagnosis and Management of Castleman Disease.[J] .J Natl Compr Canc Netw, 2019, 17: 1417-1419.
-
Berruti A , Tiberio G A M , Sigala S .Adrenocortical Carcinoma[J].Cancers, 2021,13(5):1077.DOI:10.3390/cancers13051077.
慢性心衰,这个听起来就让人有点紧张的词,其实就是心脏这位“老伙计”因为长期超负荷工作,或者受到了某些“不速之客”(比如高血压、冠心病等)的骚扰。渐渐地,它开始觉得力不从心了,不再是那个能轻松应对各种挑战、活力四射的“年轻人”,而是变成了需要小心翼翼呵护、容易疲惫的“老爷子”。
设想一下这个画面,你原本可以一口气爬上五楼不带喘的,现在走两步就得停下来歇歇。以前能吃嘛嘛香,现在稍微多吃点就感觉胸口像压了块大石头,更别提那些突如其来的“心累”感,好像整个世界都压在了你的肩膀上。这其实就是慢性心衰在悄悄给你“打招呼”呢:“我累了,要退休了,再见!”
根据公开发布的信息,我国现有心衰患者超过1200万人,且以每年新发约300万人的速度高速增长。这表明慢性心衰在我国的患病人数是一个庞大的群体,并且呈现出逐年增加的趋势。
慢性心衰的症状
慢性心衰全称为慢性心力衰竭(Chronic Heart Failure,CHF),是一种临床综合征,它通常是在器质性心脏病的基础上逐渐发展而来。它可能导致患者的心脏负担逐渐加重或者心肌的收缩力逐渐减弱,使得心脏无法有效泵送足够的血液以满足身体各部位的需求,从而引发一系列症状。这些症状包括了:
呼吸困难
高强度活动后出现的心悸、气促。心衰早期,心脏在应对额外负荷时可能显得力有未逮,导致血液回流受阻,肺部淤血,进而引起呼吸困难。随着心衰的进一步发展,即使在休息状态下,肺部淤血也会持续存在,导致呼吸困难进一步加重,甚至卧床休息时仍感到呼吸困难,需要端坐位呼吸。
身体乏力
心衰导致全身各组织器官供血不足,尤其是肌肉组织受影响最大,从而引起患者身体乏力、活动耐力下降。
水肿
由于心脏泵血功能减弱,体循环淤血,尤其是下肢静脉回流受阻,导致液体在组织间隙积聚,严重时可延及胸腹部。水肿现象晨轻晚重,且常伴有腹胀、食欲缺乏、恶心呕吐、尿少等症状。
慢性心衰的致病因素
那么在探讨 CHF 时,深入理解造成其现象的根本原因至关重要,因为这些原因揭示了推动 CHF 发展的核心机制。这些原因大致可以划分为四大类别:
首先,我们来看传统因素,它涵盖了诸如缺血性心脏损伤、高血压以及代谢综合征(包括糖尿病、向心性肥胖和高脂血症)等,这些因素在大多数 CHF 患者中都能找到踪迹。
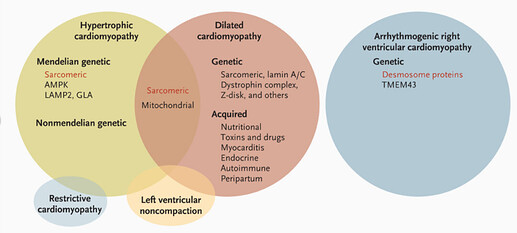
其次,遗传性心肌病也会导致心力衰竭,目前认为这种情况来源于常染色体显性突变及家族聚集的现象。这些等位基因突变频率虽然较低,但它们在病理生理学上却具有显著影响。英国牛津大学心血管医学系的 Hugh Watkins 博士就汇总了这种遗传性的心肌病,包括肥厚型心肌病(Hypertrophic Cardiomyopathy,HCM),扩张型心肌病(Dilated Cardiomyopathy,DCM)和致心律失常性右室心肌病(ARVC)等。并且针对这些遗传性心肌病,他还提出了许多基因型与表型之间复杂关系。
再一个,便是主要由心脏瓣膜功能异常引起的机械性因素。特别是老年人中常见的主动脉瓣狭窄,它会导致左心室(Left Ventricle, LV)承受过高的压力负荷。起初,这种压力负荷会导致心脏代偿性肥大以抵消部分负荷,但长此以往,左心室的功能会逐渐受损,导致心脏泵血能力下降,心律失常。左心室肥大会导致心肌细胞的增多,这会限制心脏的收缩和舒张能力;心肌细胞增多使得心脏在收缩时不能有效地将血液泵出,导致全身血液循环障碍。这一过程同样在小鼠模型中得到了验证。
这三个因素的共同点是,它们导致的初始损伤并非直接源于免疫系统,而是激活免疫系统作为后续反应参与其中。
最后一类因素直接关联于免疫系统,包括自身免疫反应和由病毒、细菌等感染引起的免疫性心肌损伤。心脏损伤后,坏死细胞死亡导致组织驻留免疫和非免疫细胞的激活,这些细胞产生促炎细胞因子和趋化因子,负责将炎性白细胞从血液募集到组织损伤区域,先天免疫系统和适应性免疫系统均被激活,成纤维细胞活化和内皮细胞增殖,最终导致修复性心肌纤维化和血管生成。
总的来说,心力衰竭的诱因复杂多样,从传统的危险因素到遗传性疾病,再到机械性损伤和免疫介导的病理过程,每一类都为我们揭示了 CHF 发展的不同方向。
不过不要过分担心,虽然这位“老爷子”想要“退休”,但我们还是有办法帮它一把,让它继续在我们的身体里发光发热。
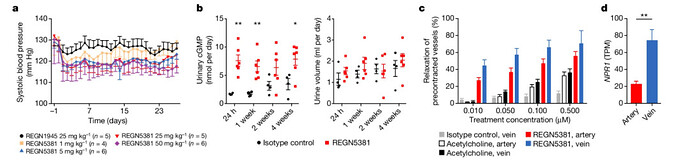
从调整生活方式到药物治疗,再到各种先进的医疗手段,科学家们可是想尽了办法来应对这位“任性”的合作伙伴。近期,便有美国科学家 Michael E. Dunn 在《科学》杂志上发表了针对心力衰竭靶向药物的研究。他们开发出了一种新型激动剂单克隆抗体 REGN5381,这种单克隆抗体可以靶向结合利钠肽受体(NPR1),从而有效降低静脉压力,并持久改善心力衰竭患者和动物模型的血液动力学状态。
实验数据表明,体外实验以及通过小鼠、比格犬和食蟹猴等动物模型进行的在体实验中,REGN5381 药物均展现出了对血管的扩张效应。值得注意的是,这种扩张作用在静脉系统中比在动脉系统中表现得更为突出。进一步观察发现,REGN5381 治疗显著促进了 cGMP(环磷酸鸟苷)的生成,且在小鼠实验中,当给予最高剂量时,其降压效果能够持续长达28天之久。并且,当REGN5381与血管紧张素转换酶抑制剂或血管紧张素受体阻滞剂联合应用时,展现出了增强的协同降压效果。
因此,研究 CHF 的发病机制及探索新的治疗策略,制作合适的动物模型来模拟CHF的症状是非常重要的。其中,慢性心衰小鼠模型因其生理特性与人类相似度高,操作相对简便而成为热门模型。
小鼠慢性心衰造模方法
小鼠慢性心衰的造模方法,主要可分为压力超负荷引起的心力衰竭、血容量超负荷引起的心力衰竭和化学因素引起的心力衰竭。接下来将介绍两种最为常用的造模方法。
3.1 主动脉缩窄术(Transverse Aortic Constriction, TAC)
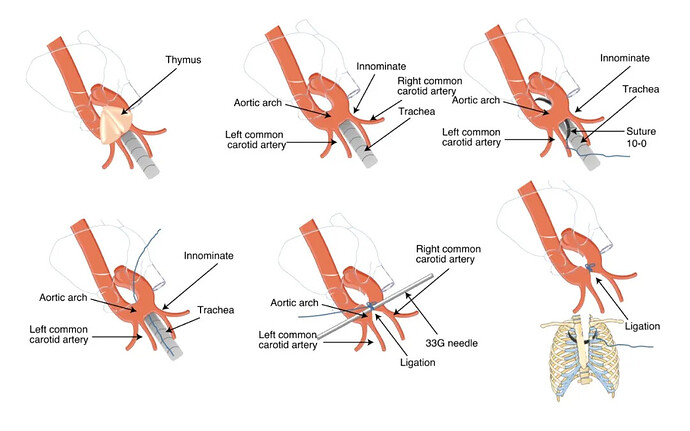
主动脉缩窄术是目前常用的一种手术造模方法,通过手术将主动脉与特制的注射针头或缩窄环捆绑在一起,造成主动脉狭窄,从而增加心脏的负荷,引发心肌肥厚并最终导致心力衰竭。具体操作包括麻醉、开腹、暴露腹主动脉、穿线结扎等步骤。这种造模方法适用于高血压导致的心力衰竭、左心室后负荷过高致心衰的机制研究等。
术后动物可能出现毛发蓬松、稀疏、干燥无光泽,活动力降低,呼吸频率加快,体重增长缓慢等表现,且上述表现随建模时间增长而愈加明显,术后2周后便会出现心室肥厚,4周便会出现心衰指征。
这种方法经济实用,模型稳定可靠,重复性高。但是造模时间较长,狭窄程度难以精确控制,而后者决定了 TAC 的严重程度,通常由所用针头的规格(G)决定。
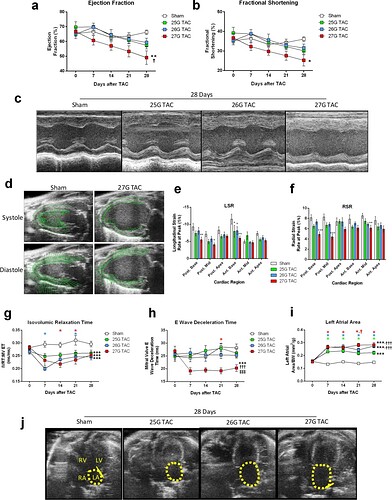
塔夫茨医学中心分子心脏病学研究所的 Daniel A. Richards 团队使用不同规格的针头进行了TAC研究,他们评估了轻度(25G)、中度(26G)和重度(27G)TAC在28天内对小鼠的影响,同时检查器官重量、超声心动图、侵袭性血流动力学、基因表达以及肾脏的结构和功能。
研究发现所有 TAC 模型均具有低死亡率、显著的心脏肥大和中重度舒张功能障碍。中度 TAC 组小鼠还出现轻中度收缩功能障碍和轻度心脏纤维化,而重度 TAC 组小鼠心脏出现严重的收缩和舒张功能障碍,以及心肌纤维化,并且更易表现出心力衰竭的特征。三种 TAC 严重程度中的每一种都可以作为不同临床前表型的模型。
28天的轻度 TAC 反应代表了一种没有收缩功能障碍或心脏纤维化的肥大和舒张功能障碍模型,与高血压心脏病的人类状况一致。在没有一个被广泛认可的小鼠模型来模拟射血分数保留的心力衰竭(HFpEF)的情况下,这是一种非常有用的工具。此外,它还有另一个潜在的用途,那就是研究如何通过遗传或药物手段来干预并预防心肌的过度肥大或异常增长。由于轻度 TAC 能够诱导出轻度的心肌肥大表型,这就提供了一个宝贵的途径,可以更深入地探索心肌肥大的机制,以及可能的治疗策略。简而言之,这个造模方法方法提供了一个全新的视角,能够在更广阔的范围内研究 HFpEF 及其相关疾病的治疗。
3.2 药物诱导法
药物诱导法是通过注射某些具有心脏毒性的药物如阿霉素(Doxorubicin)、异丙肾上腺素(Soprenaline)等来诱导实验动物发生心力衰竭的造模方法。阿霉素是一种蒽环类化疗药物,可导致心肌组织氧自由基的损伤和生物膜脂质的过氧化反应。而异丙肾上腺素是一种β-肾上腺素受体激动剂,可引起心肌细胞钙超载和心肌持续强烈收缩。这种造模方法的优点是操作简单,能模拟特定类型的心力衰竭。缺点是这种可能受到多种因素的影响,如小鼠的个体差异、药物代谢的差异、实验环境等,导致模型的稳定性和一致性有差异,左心室功能受损程度也不同。同时这种造模方法导致动物的心律失常发病率和死亡率也较高。
此外,常用的异丙肾上腺素诱导模型还需要进行复杂的给药剂量和周期的摸索。Sunny C. Chang 对于该方法进行了统计汇总,从文中我们不难得知针对不同品系、不同周龄、不同性别的小鼠,药物的注射方式都有较大差别,即使是同一种小鼠品系不同文献报道间也存在差异,因此,每一个独立实验室在建立模型时都必须进行预实验。
一般来说,小鼠 CHF 造模成功后,通常会表现出与人类心衰相似的症状,包括:
呼吸困难
由于心脏功能减退,导致肺循环淤血,小鼠会出现呼吸困难的症状。
水肿
心衰导致体液在组织间隙中积聚过多,小鼠会出现水肿现象。这主要表现为双下肢水肿、腹水等。
胃肠道症状
由于心输出量下降,消化系统供血不足,小鼠会出现食欲不振、恶心呕吐、腹泻等胃肠道症状。出现以上症状表明心衰很可能影响了小鼠的消化系统功能。
尿量减少
心衰导致肾脏灌注压降低,肾小球滤过率下降,从而导致尿量减少。这一症状可能反映了心衰对小鼠泌尿系统的影响。
肝脾肿大
心衰会影响肝脏的功能,导致胆汁无法正常排出,从而引起肝脾肿大。在小鼠心衰模型中,这一症状可能表现为肝脏和脾脏的体积增大。
运动耐力下降
心衰小鼠的运动耐力通常会下降,表现为活动减少、易疲劳等症状。这可能与心脏泵血功能障碍导致全身供血不足有关。
心衰造模成功的标准通常基于多个方面的综合评估,其中最常用的包含以下的一些检测指标:
超声心动图检查
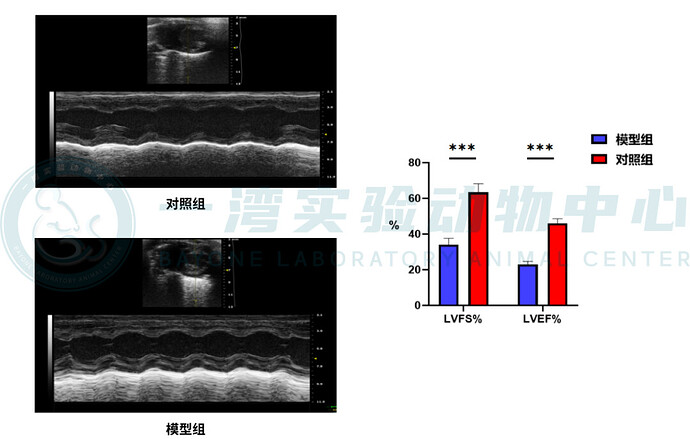
心脏超声检查是评估小鼠心功能变化的重要手段。通过测量左心室射血分数(EF)、左心室收缩末期内径(LVESd)、左心室舒张末期内径(LVEDd)以及左心室短轴缩短率(FS)等参数。本中心的数据显示,与正常小鼠进行对比,模型小鼠通常表现出 EF 和 FS 值显著降低的超声心动图特征。
血流动力学检测
通过血流动力学检测可以评估小鼠的心脏泵血功能和心室压力等参数。
心衰小鼠可能表现出左心室压力下降、心室舒张末期压力升高等血流动力学异常。
病理组织学检查
本中心对小鼠心脏进行病理组织学检查,与对照组相比,模型小鼠的心脏组织通常表现出心肌细胞排列紊乱、间质纤维化等病理特征,同时伴有心肌细胞变性、坏死、肥大等病理变化。
生化指标检测
通过检测小鼠血清中的脑钠肽(BNP)、肌钙蛋白(TnT或TnI)等心衰相关生化指标,可以辅助判断心衰造模是否成功。心衰小鼠的血清脑钠肽水平通常显著升高,肌钙蛋白也可能出现异常变化。
综上所述,慢性心衰是一种严重的临床综合征,需要引起足够的重视。小鼠动物模型作为心血管疾病研究中的重要手段,可以模拟心衰的病理生理过程,为深入理解心衰发生机制、评估治疗效果及开发新疗法提供了坚实的实验基础。
参考文献:
-
Watkins H, Ashrafian H, Redwood C. Inherited cardiomyopathies. N Engl J Med. 2011 Apr 28;364(17):1643-56. doi: 10.1056/NEJMra0902923. PMID: 21524215.
-
Dunn ME, Kithcart A, Kim JH, Ho AJ, Franklin MC, Romero Hernandez A, de Hoon J, Botermans W, Meyer J, Jin X, Zhang D, Torello J, Jasewicz D, Kamat V, Garnova E, Liu N, Rosconi M, Pan H, Karnik S, Burczynski ME, Zheng W, Rafique A, Nielsen JB, De T, Verweij N, Pandit A, Locke A, Chalasani N, Melander O, Schwantes-An TH; Penn Medicine Biobank; Baras A, Lotta LA, Musser BJ, Mastaitis J, Devalaraja-Narashimha KB, Rankin AJ, Huang T, Herman G, Olson W, Murphy AJ, Yancopoulos GD, Olenchock BA, Morton L. Agonist antibody to guanylate cyclase receptor NPR1 regulates vascular tone. Nature. 2024 Sep;633(8030):654-661. doi: 10.1038/s41586-024-07903-1. Epub 2024 Sep 11. PMID: 39261724; PMCID: PMC11410649.
-
Richards DA, Aronovitz MJ, Calamaras TD, Tam K, Martin GL, Liu P, Bowditch HK, Zhang P, Huggins GS, Blanton RM. Distinct Phenotypes Induced by Three Degrees of Transverse Aortic Constriction in Mice. Sci Rep. 2019 Apr 10;9(1):5844. doi: 10.1038/s41598-019-42209-7. PMID: 30971724; PMCID: PMC6458135.
-
Malek Mohammadi M, Abouissa A, Heineke J. A surgical mouse model of neonatal pressure overload by transverse aortic constriction. Nat Protoc. 2021 Feb;16(2):775-790. doi: 10.1038/s41596-020-00434-9. Epub 2020 Dec 16. PMID: 33328612.
-
Chang SC, Ren S, Rau CD, Wang JJ. Isoproterenol-Induced Heart Failure Mouse Model Using Osmotic Pump Implantation. Methods Mol Biol. 2018;1816:207-220. doi: 10.1007/978-1-4939-8597-5_16. PMID: 29987822; PMCID: PMC6445258.
“想过离开,以这种方式存在,是因为,那些旁白,那些姿态,那些伤害…不想离开, 当你的笑容绽开,这世界突然填满色彩 。”大家是否还记得华晨宇在 2019 年发布的这首《好想爱这个世界啊》?这首歌的创作初衷是为了让大众更加了解和关注抑郁症群体,歌词描绘了抑郁症患者内心的挣扎与渴望,从“抱着沙发,睡眼昏花,凌乱头发,却渴望像电影主角一样潇洒”到“伤疤,就丢给回忆吧,放下,才得到更好啊”,每一句都触动着人心,让人感受到抑郁症患者的孤独与无助。
那么何为抑郁症呢?在探讨人类情感与心理健康的广阔领域中,抑郁症这一话题显得尤为沉重且必要。它如同一片不经意间笼罩在心灵天空的阴霾,让人在光明与希望之中感受到前所未有的孤寂与沉重。抑郁症,一种以显著而持久的情绪低落为主要特征的心理疾病,它不仅仅影响着患者的情绪、兴趣和行为,还能导致睡眠障碍、食欲改变、自我评价过低等症状。
研究发现,抑郁症的影响因素主要是“下丘脑—垂体—肾上腺轴”的过度激活,但其具体神经机制尚不清楚,一般认为主要由脑内多巴胺(DA)、血清素(主要是 5-HT)、去甲肾上腺素(NE)水平异常导致。抑郁症的研究热点主要分为以下几个方向:抑郁症的一般症状、抑郁症的风险、抑郁症的影响、抑郁症的动物模型、抑郁症的相关脑区和功能联系、抗抑郁药和抑郁症治疗、抑郁症与其他疾病的合并症、抑郁症的流行病学、初级保健中的抑郁症管理以及抑郁症的分类(图 2)。今天,我们来为大家初步介绍一下抑郁症动物模型分类及其造模方法。
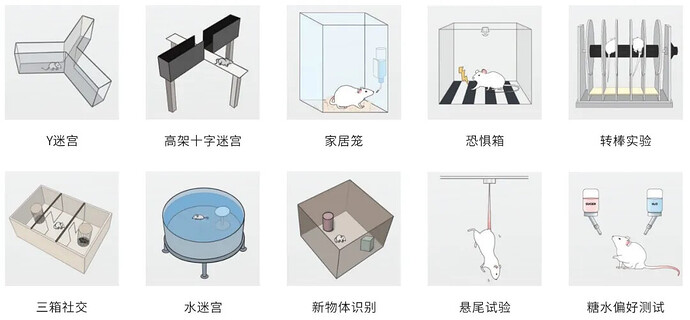
建立适当的动物模型是深入研究抑郁症的发病机制和干预方式等领域的必要基础。外界压力是导致易感个体产生抑郁的前提,压力和抑郁之间的这种既定联系促使研究人员开发了压力应激的动物模型。目前广泛使用的基于压力应激的抑郁症动物模型有社交挫败、慢性不可预测性应激、习得性无助、母婴分离模型、慢性束缚、社交孤立、睡眠剥夺、强迫游泳等(图 3) [1]。
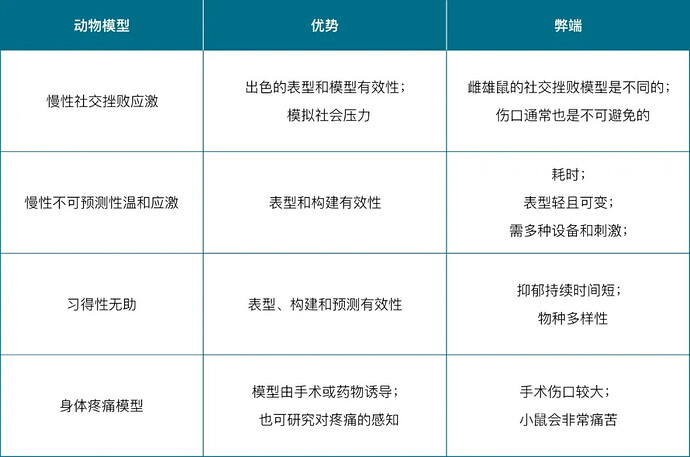
Xiangyun Tian 等人全面比较了这些抑郁症模型的优缺点,以帮助研究人员选择合适的动物模型进行抑郁症研究(表 1)。
抑郁症造模方法:
A 慢性社交挫败应激 (Chronic Social Defeat Stress,CSDS)
在该模型中,将 C57BL/6j 小鼠多次暴露于具有强领地意识和攻击性的 CD-1 小鼠笼中每天 5-10 分钟,连续 10 天诱导抑郁症,小鼠长期承受一定的身体和心理压力,易感小鼠由于多次被攻击压迫而表现出斗争消极状态以及情绪低落的现象,对应于社交回避和快感缺乏等抑郁样行为[2]。
B 慢性温和应激(chronic Mild Stress,CMS)和慢性不可预测性温和应激(chronic Unpredictable Mild Stress,CUMS)
两种诱导模型都是采用比较温和的轻度应激源来刺激动物。CMS 一般采用重复性的单一应激源,通常会导致动物适应该种刺激,在模型建立后期,反而可能减少抑郁和焦虑样行为的产生[3]。在 CUMS 模型中,通过一系列重复少且不可预测的温和性刺激,包括束缚、电击足底、通宵照明、禁水、禁食、换笼饲养等多种刺激方式,随机选用并持续数周或数月,诱导动物产生长期有效的抑郁样行为,更有效地反映了人类生活压力源[4]。
C 习得性无助(Learned Helplessness,LH)
将小鼠暴露在不可预测且不可逃脱的足底电击条件下,重复电击造成的伤害性疼痛和不可逃脱的绝望情绪导致动物出现抑郁症样行为。模型动物表现出持续的生理变化,如体重减轻、睡眠中断、下丘脑-垂体-肾上腺轴(HPA)活动改变和海马神经可塑性失调[5] 。
D 身体疼痛模型
身体疼痛分为神经性疼痛、伤害性疼痛、术后疼痛和癌性疼痛,尤其是神经性和伤害性疼痛,是导致抑郁症的另一个主要因素。例如:感觉神经损伤引起的疼痛会导致与抑郁症相关的大脑区域的神经元死亡,例如岛叶、前额叶皮层、丘脑、海马体、前扣带回和杏仁核等区域,从而诱发抑郁情绪[6]。
E 其他模型。
除了上述模型外,近十年来,研究人员还提出了几种建模方法,如手术诱导、早期生活压力和基因编辑等。例如双侧嗅球切除术 (OBX)可以改变皮质→海马→杏仁核回路的功能障碍或代偿作用,模拟重度抑郁症[7] ;长时间的母婴分离涉及破坏母亲和她的后代之间的正常互动,会使下丘脑 - 垂体 - 肾上腺(HPA)轴功能失调,这可能诱发成年动物的神经生物学和情绪行为的持续变化以及海马学习和记忆功能受损[8];通过基因编辑方法,敲除 5-HT 转运蛋白 5-HTT(-/-)的小鼠在行为测试中表现出焦虑和抑郁症样反应[9]。
结语
在这次小鼠抑郁症造模的介绍中,我们见证了科学的力量和人类的智慧。希望通过我们的介绍,你能够对抑郁症及目前现有的小鼠造模技术有更深的认识,也对这些默默付出的小鼠们多一些敬意。






![图 2. 抑郁症研究热点[1]](https://community.behavioratlas.cn/uploads/default/original/2X/9/9c9ae3933d4e3323984c3bc5927c9566e60e2874.jpeg)
![图 3. 抑郁症动物模型[1]](https://community.behavioratlas.cn/uploads/default/optimized/2X/1/1aacd4f9e6fb2bbeaccb29002715bb6e0d9368c5_2_684x500.jpeg)