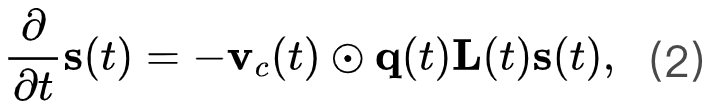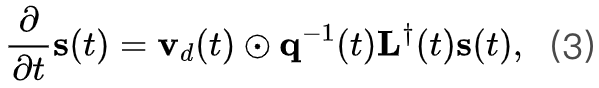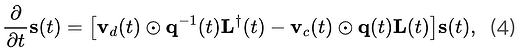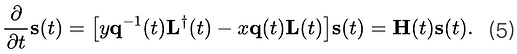大脑如何get笑点,还让你哈哈大笑?
01 大脑如何get笑点,还让你哈哈大笑?
当我们看到一个段子放声大笑的时候,大脑里究竟发生了什么? 心理学上认为,幽默的加工机制可分为两个阶段,即幽默理解(humor comprehension)和幽默欣赏(humor appreciation),它们是截然不同的复杂认知过程。幽默理解,即理解一个笑话,是一个问题解决的过程,通常只发生一次。而幽默欣赏,即为欣赏一个笑话,可以通过进一步的阐释反复体验,这也解释了为什么有些笑话即使在笑点被人知晓后依然有趣。
当我们感受到幽默时,首先需要在认知层面上进行语言加工,理解笑话的“梗”在哪里。这通常源自逆心理常规反差,当感受到意外或惊讶的时候,更会令人发笑。幽默欣赏是指在意识到笑话的“梗”后的产生的奖励机制以及情感反应,让我们体会到愉悦感。
一项来自Journal Of Neuroscience上的最新研究,利用功能性核磁共振成像技术(fMRI)揭示了幽默的神经机制,大脑中的背侧纹状体(dorsal striatum)和腹侧纹状体(ventral striatum)同时负责幽默理解,而腹侧纹状体负责幽默欣赏。
研究人员招募了26名的年轻被试,并分析了他们在听到笑话或看到喜剧时的大脑激活状态。在第一项实验中,被试需要在听到一段音频后判断这段音频是否为笑话,并为其搞笑程度评分。第二项实验中,他们只需静静观看情景喜剧的片段。
在这项研究中,幽默理解被定义为,听到笑话时(实验1)和喜剧中背景笑声发生前两秒(实验2),幽默欣赏被定义为评价笑话搞笑程度时(实验1)和背景笑声中间两秒(实验2)。
通过对比接受笑话和非笑话信息时的大脑活动,结果显示:背侧纹状体在幽默理解时出现了明显激活。背侧纹状体在功能和结构上与前颞皮质区域(frontotemporal cortical region)相连接,而这些区域被认为与幽默理解及相关过程有关。因此,这表明背侧纹状体参与了理解幽默的认知过程,包括认知灵活性和工作记忆。
腹侧纹状体则在幽默理解和幽默欣赏两个阶段都出现了明显激活。腹侧纹状体被认为与奖励机制有关。因此,对潜在奖励或不一致性解决的预期可能会激发理解幽默的过程,以助于更好地理解幽默。
除了背侧纹状体和腹侧纹状体,该研究还揭示了参与幽默加工的脑区活动。比如,与语义处理相关的下额回沟(inferior frontal gyrus)和中颞回(middle temporal gyrus),以及涉及情感处理和社会认知的脑区的杏仁核(amygdala)和颞极(temporal pole)。
总结来说,这项研究展示了背侧纹状体和腹侧纹状体分别在幽默理解和幽默欣赏中发挥重要作用,并揭示了在理解幽默时涉及不同的认知功能,如语言理解,信息整合,情感认知等。此外,在以往研究中有证据表明,帕金森病患者在幽默理解方面存在缺陷,但在幽默鉴赏方面却没有。这项研究提供了潜在的临床意义,为干预帕金森病等特殊病症个体的幽默加工能力缺失,提供了新的参考价值。
02 一叶知森:从单个细胞开始理解小脑
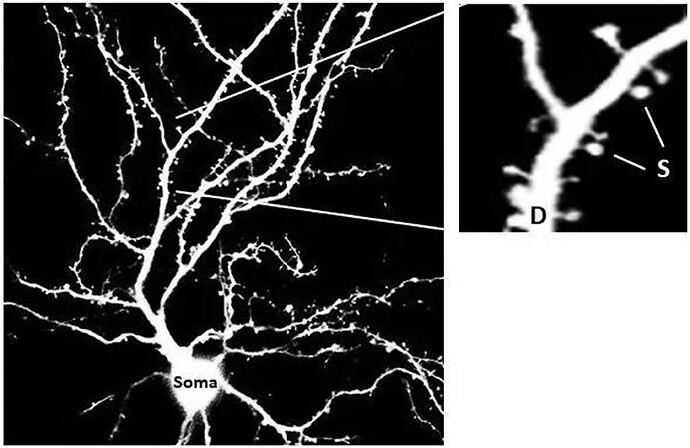
从前科学家们曾认为,哺乳动物的小脑仅负责运动控制,细胞种类和排列也相对简单。但近年越来越多的研究却发现,小脑也同样参与认知、情感和语言,区域性结构亦相当复杂多样,在演化史上,更是随着哺乳动物的智慧之源新皮质同步扩张,所含神经元达大脑数倍。
而RNA是细胞实际功能的信息承载者与重要调控者,针对单细胞的RNA测序技术(single-nucleus RNA sequencing, snRNA-seq),恰可让我们从单个细胞了解小脑的过去与现在,这就好比能从一叶中,窥见整片森林中的千百种树木,与形成这片森林的千万年岁月。
近日,在一项发表在《自然》、以加速文章预览(Accelerated Article Preview)形式提前与读者见面的研究中,研究者对人类、小鼠、有袋负鼠(marsupial opossum)三类哺乳动物各个发育阶段的高达400000个小脑细胞进行了单核RNA测序,并以此进行了细胞的一致性分类、细胞时空分化动态、基因表达模式差异以及三种哺乳动物的阶段匹配和演化分歧等相当详尽的分析,从而向读者展示了由RNA展现出的、小脑细胞的现状与历史。
细胞最基础的信息便是其分类,而基于RNA分类则是因为能实际展现遗传信息。 通过对测序信息所展示的每个物种全阶段转录谱的整合,研究者基于细胞的发育起源,而将小脑细胞分为广泛的系谱,得到了多种细胞类型、分化状态和待分化状态,在分类过程中,他们也使用了已知的细胞类型标记和公共原位杂交等数据。
分类后,研究者也得以比较不同种生物的发育,新生儿的小脑在发育阶段上被与小鼠和负鼠的所对应,这一对应也得到了先前形态学研究和多器官对应性的验证。通过发育过程中细胞类型丰度的比较,也发现三个物种小脑细胞动态模式的相似,这也与当前对小脑发育的理解一致。但除共同性之外,尤其由基因表达的演化改变造成的差异也没有被研究者们忽视,这些差异会使得在模式动物中成立的一些情况可能无法在人类上同样奏效。这一项比较通过一套用于研究演化的比较机制完成。
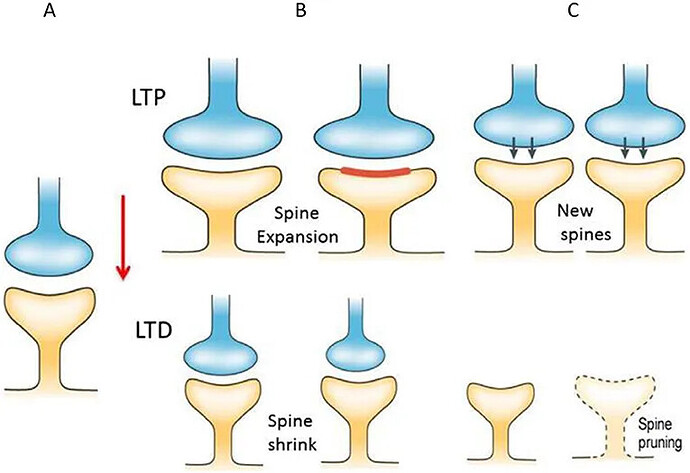
研究者对各个发育过程进行了相当详尽的RNA测序,这也让整个发育过程的时空细胞类型分化情况清晰可见。研究者们尤其重视小脑的计算核心浦肯野细胞的发育过程,检测细胞类型抑制性发现,具有不同沉降模式的浦肯野细胞同时由其出生日期和出生地所指定。与其他哺乳动物中的保守不同,研究者们也发现了人类小脑中浦肯野细胞的亚型比例变化,这可能与早期出生时浦肯野细胞的增加有关。其他神经元的时空分化动态也得到研究,其结果表明,小脑神经元的多样性和祖细胞的特异性相一致,且在哺乳动物的发育中有着整体保守性。
在建立了发育阶段、细胞类型和状态之间的跨物种对应关系之后,研究者还对三个小脑数据集中的基因表达进行了主成分分析(principal component analysis, PCA),这是一种分析构成事物间差异最主要原因的算法,其所得的前三项主成分,也就是构成基因表达模式差异的最主要因素依次分别是年龄、神经元还是胶质细胞以及更进一步的细胞类型划分。这一结果展示,发育中小脑的基因表达差异在很大程度上,可以通过物种共享的发育和细胞类型信号来解释。
基于这一观点,使用类似于先前的跨物种比较方法,研究者对决定小脑细胞类型的核心基因表达程序进行了分析,从而发现了多种细胞共用、两种细胞共有和与细胞类型绑定的基因,也发现了这些与细胞类型密切相关的基因中,许多都存在高度的保守性,从其一些已知功能看,这可能对实现该类型小脑细胞功能至关重要。
研究者还对三个物种都鉴定了在神经元分化过程中动态表达的同源基因,这些结果表明,许多与小脑疾病相关的基因可能影响不止一种神经元类型。
以RNA为视角管窥组织的发育和演化过程,这称不上是多么新奇的想法,但如本研究这般,收集了相当详尽的数据,并进行多方面多视角的分析利用,则实属不易。对有兴趣或有研究需要的读者来说,这样一项以数据为核心的研究,既可以从中学习方法,也可以进一步利用该研究的数据,可以称得上是一座宝藏。
03 还是胎儿时,我们就已开始学习语言?
研究表明,婴幼儿在语言学习方面的惊人天赋并非只是在出生后才显现,而是在子宫内就已经开始发芽。尽管宫内环境如同一个低通滤波器,会衰减600HZ以上的频率,但在此过程中语音的旋律和节奏得以保留,这也许是新生儿喜欢母亲的声音而不是其他女性的声音,并表现出对母亲在怀孕期间所说语言的偏爱的原因。
虽然与成人相比,人类婴儿很容易就能掌握语言,但婴儿大脑在语言上显著可塑性的神经基础是什么,这对我们仍然是个谜团。
那么,究竟是什么样的神经机制使得发育中的大脑能够从语言经验中学习?产前听到的语言刺激是否会诱发动态变化,从而支持新生儿大脑活动中的学习?近来,一篇来自《科学进展》的最新研究指出,产前的语言暴露会对婴儿大脑的发育产生长远影响,尤其是对母语的敏感性。
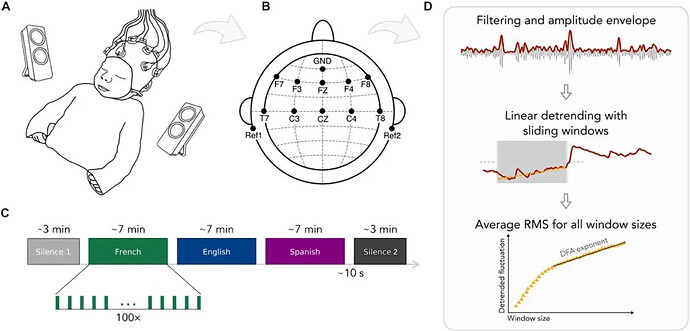
实验对象包括33名产前暴露于法语环境中的新生儿(平均年龄为出生后2.5天)以及其母亲(母语为法语)。在婴儿睡觉时,研究人员给他们播放了儿童故事的3种语言版本(法语、西班牙语和英语)的音频(每段音频约7分钟,播放顺序已做伪随机化和平衡),并监测了他们在听录音前(静息态)、听录音时和录音后(静息态)的脑电波。
为了评估音频的语言暴露对大脑的影响,研究人员对比了听录音前后的脑电图数据。结果显示,在听过语音后,脑电信号的长程时间相关性(long-range temporal correlations,LRTCs)增强,尤其是在θ频段(4 ~8 Hz)。θ频段被认为与认知音节级别的语音单元有关。因此这意味着,暴露于短暂的语言刺激后,新生儿的脑电信号在时间上更具有协同性和持续性,这可能与学习和语言发展有关。
更重要的是,对比语种的影响时,只有法语,即新生儿产前暴露的语种,增强了θ频段的长程时间相关性。也就是说,新生儿对法语的音节更为敏感,“记得”在子宫中的听到的语言。这表明产前的语言经验在仅仅出生数天的婴儿大脑神经发育中的作用。
总结来说,这项研究证明,产前的语言暴露,尤其是母语,会对婴儿大脑的功能产生促进作用。虽然这种影响对儿童的语言学习并不产生决定性影响,但这项研究证明了出生仅数天的婴儿大脑就已经表现出对母语的敏感性。这意味着新生儿的大脑虽然未发育完全,但可能已经处于对语音和语言进行高效处理的最佳状态。
从另一角度来看,这些结果似乎也强调了产前语言刺激的必要性。在怀孕期间与胎儿进行语言互动,如阅读书籍、讲故事或播放音乐等,可能有助于促进婴儿的语言学习。此外,产前经验的促进作用是否仅限于言语领域仍是一个未决的问题。未来的神经影像学研究也是必要的,用以进一步检验产前学习的神经时间动态变化。